-
开花是被子植物生活史上的一个重要阶段,是大多数有花植物性成熟的标志。植物的花开放物候体现了花开放的季节性和周期性规律,是植物应对环境变化的策略,也是开花生殖重要的组成部分,可以为进一步研究植物的形态结构、生理生态特性以及进行杂交育种提供依据[1]。然而植物花开放受多种因素影响,形成了一个复杂的调控网络,调控机制尚未清楚。目前,花开放由内部和外部因素共同影响。外部因素包括光、温度、相对湿度、气压以及生物因素等[2],内部因素主要是激素变化、细胞壁扩张、生物钟节律、水通道蛋白合成和碳水化合物代谢等途径[3−5]。许多植物激素与植物的成花诱导和开花结实关系紧密,如柑橘Citrus reticulata花瓣中脱落酸(ABA)含量随开花时间的延长而增加,高含量赤霉素(GA3)延迟番茄Solanum lycopersicum[6]开花,较低含量使番茄开花和花序发育较早。花瓣上下表皮细胞的生长差异、膨胀与收缩,影响着花朵开闭[7]。此外,花朵开放需要消耗大量的能量,碳水化合物作为主要的能源物质,其含量对花开放进程有很大的影响。
紫薇Lagerstroemia indica是桃金娘目Myratles千屈菜科Lythraceae紫薇属Lagerstroemia的落叶灌木或小乔木[8]。原产中国长江流域及华南各省,现各地广为栽培。紫薇花色鲜艳美丽,有紫色、红色、粉色、白色等多种花色,具有很高的观赏价值,其花期在夏季,花期长、枝干光滑、抗污染,是园林绿化的好材料。目前,关于紫薇花开放的研究多在开花生物学、形态学、繁育特性等方面[9−13],紫薇花开放生理层面的研究尚未见详细报道。本研究对紫薇开花期物候进行了观测,研究了紫薇花开放过程中细胞形态、细胞相对含水量、碳水化合物质量分数和内源激素等的变化,以揭示紫薇花开放的生理机制,有利于优化紫薇栽培措施,提高其观赏价值和经济效益,对紫薇花期调控以及花开放相关分子机制研究有重要意义。
-
选取栽植在浙江农林大学校园(119°72′69″N,30°25′65″E)的10株冠幅、株高、树龄较为一致的紫薇,植株生长状况良好且无病虫害。在2022年7月上旬时进行观察并采样,根据花开放物候观测,采集花开放各个时期的花以及花部结构。将样品于液氮中速冻,保存在−80 ℃超低温冰箱中备用。设置3次生物学重复。
-
于2022年7月上旬上午8:00开始观测紫薇植株,依据紫薇单花开放时期,分阶段观察并记录花朵开放程度,进行拍照记录并描述开放进程的形态特点,记录各时期持续时间。
-
根据紫薇花开放的时期,选取每个时期的花瓣进行扫描电镜观察,观察上下表皮细胞的形态[14]。于晴天上午8:00剪取花枝插入水中,及时带回实验室进行解剖,剥除萼片、雌蕊、雄蕊等花器官,留存花瓣,洗净擦干后,剪成0.5 cm × 0.5 cm大小,进行固定及脱水。将经过梯度脱水处理的样品放置于Hitachi HCP-2型临界点干燥仪中进行干燥处理,并采用离子溅射镀膜法进行镀膜。最后将镀过膜、喷过金的样品放置在Hitachi SU-
8010 型扫描电镜中进行观察。 -
利用烘干称量法[15]测定。分别称取0.1 g紫薇不同花开放时期的花瓣、萼片及花苞/花的鲜质量,洗净后放入烧杯中,蒸馏水浸泡8 h,擦干后称取水饱和质量,放入烘箱80 ℃烘干至恒量,得到干质量,求相对含水量。以上样品均进行3次生物学重复。
-
称取0.1 g花瓣样品,按照试剂盒说明书操作,分别在520、480、620、620 nm 波长下测定葡萄糖、果糖、蔗糖和淀粉的吸光度。用不同浓度的葡萄糖标准溶液测吸光度,绘制标准曲线,求出标准直线方程。以上样品均进行 3 次生物学重复。
蒽酮、葡萄糖标准品均购于浙江卡尔生物技术有限公司,试剂盒均购于苏州格锐思生物科技有限公司。淀粉采用了蒽酮比色法进行测定,葡萄糖则基于GOPOD 氧化酶法测定,果糖运用间苯二酚比色法测定,而蔗糖则利用蒽酮比色法进行检测。
-
称取1.0 g样品,用ACQUITY UPLC H-Class系统(沃特世)测定紫薇花开放各时期ABA、生长素(IAA)、GA3和玉米素核苷(ZR)的质量分数[15−17]。各样品重复测定3次。
-
使用Excel 2016进行数据统计,SPSS 25进行数据分析,采用皮尔逊(Pearson)检测法分析各指标之间的相关性,用Origin 9.1作图。
-
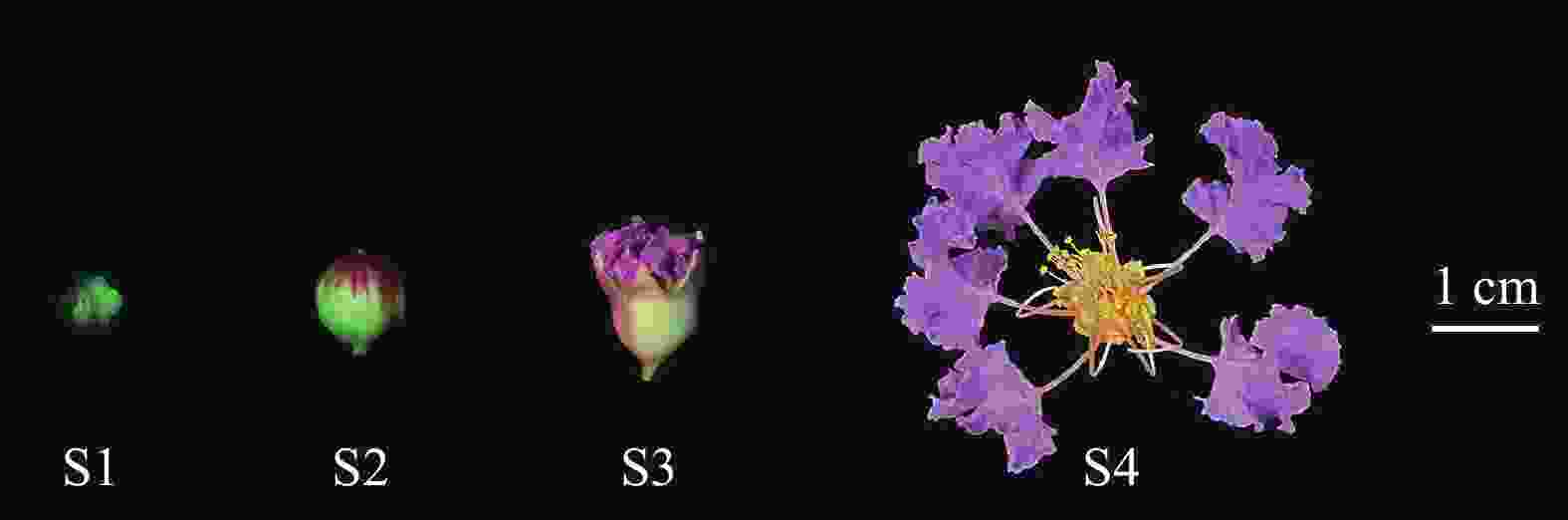
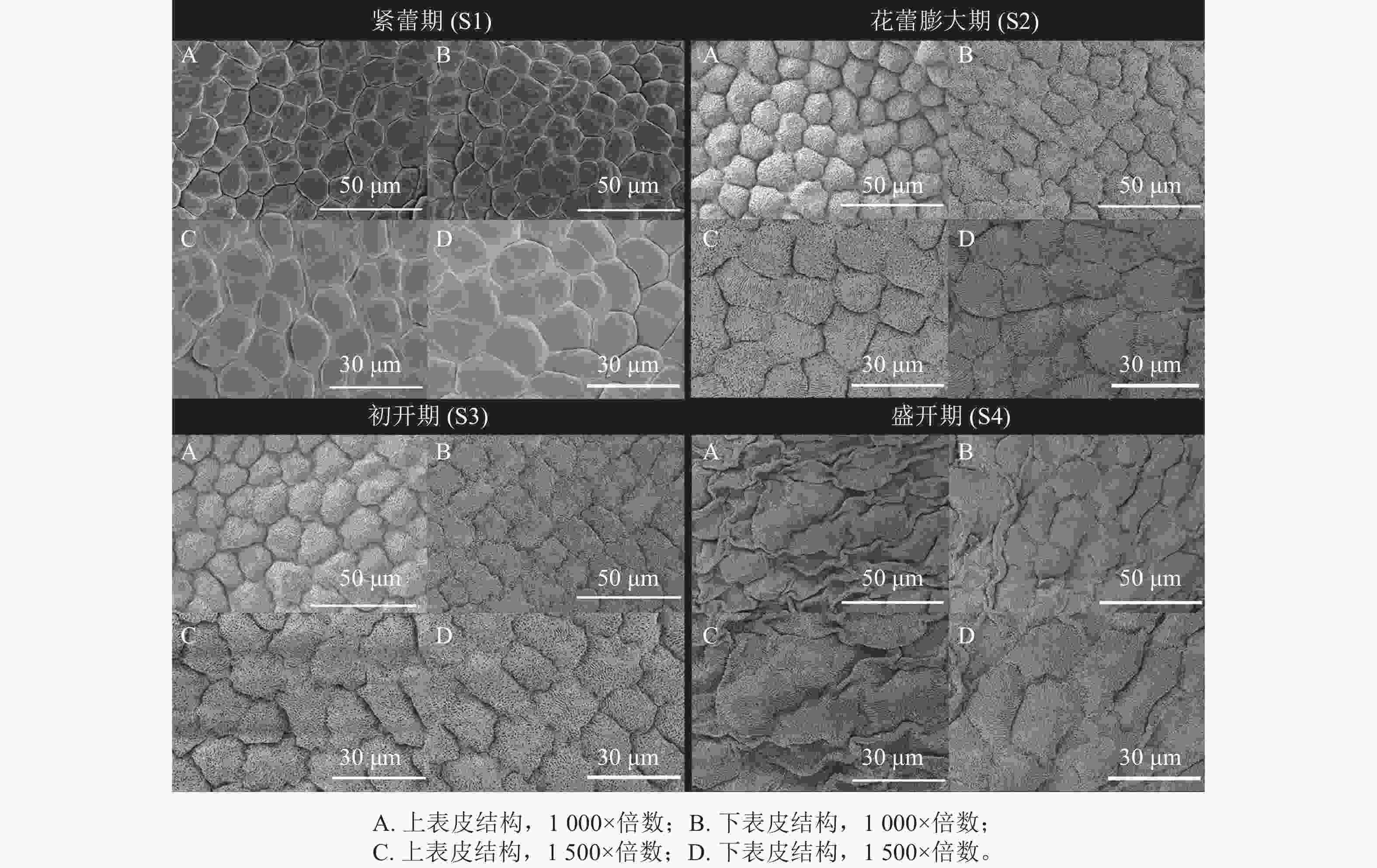
紫薇单花花开放可分为紧蕾期(S1)、花蕾膨大期(S2)、初开期(S3)和盛开期(S4)等4个时期(图1)。其中,S1时期花蕾紧闭,花蕾通体呈绿色,花瓣尚未显色,为白色偏淡绿色;S2时期花瓣开始显色,呈淡紫色,花蕾上部从绿色变为红色;S3时期花瓣逐渐裂开,花瓣及萼片逐渐伸展;S4时期时柱头伸长,花瓣及萼片完全伸展,花药开裂,柱头呈绿色并具黏液。
紫薇一般在凌晨开放,气温越高,开裂时间提前;但遇阴雨天气时,开裂时间延后,甚至不开裂,花瓣停止生长,导致开花数量减少。紫薇在23:00时,花蕾膨大至最大,花瓣开始蓬松变大;到23:15时,花蕾顶部裂开一条缝,此时花瓣迅速膨大变松直至花蕾完全裂开;翌日0:30时,被花萼紧包的花瓣逐渐向外膨胀,爪基部外露;直至6:00时,花萼完全舒展,花瓣相互分离最终完全平展,花丝向四周伸展,雄蕊群接触面积增大,花药开裂,开始散粉,柱头透明绿色,开始分泌黏液。开花第3天,花丝干枯呈褐色,花瓣边缘开始萎蔫,颜色变淡,柱头黄绿色,干燥萎缩,无黏液。开花4~6 d,花瓣凋谢。
-
如图2所示:在S1时期,紫薇花瓣上下表皮细胞轮廓明显且顺滑,呈不规则多边形,排列较紧密,细胞表面光滑,下表皮细胞较上表皮细胞稍大。在S2时期,上下表皮细胞逐渐变大、密集饱满,形状为不规则长方形,细胞间排列紧密,细胞表面不光滑布满条纹状纹饰,下表皮细胞边缘呈锯齿状,较上表皮细胞稍大,且布满褶皱。在S3时期,花瓣上下表皮细胞间隙较上一时期大,细胞分布呈波状、条纹状、辐射状等纹饰,细胞不规则,形状各异。在S4时期,花瓣上下表皮细胞明显增大,且出现皱缩,细胞表面变得不平整;下表皮细胞也出现皱缩现象,但不如上表皮明显。
-
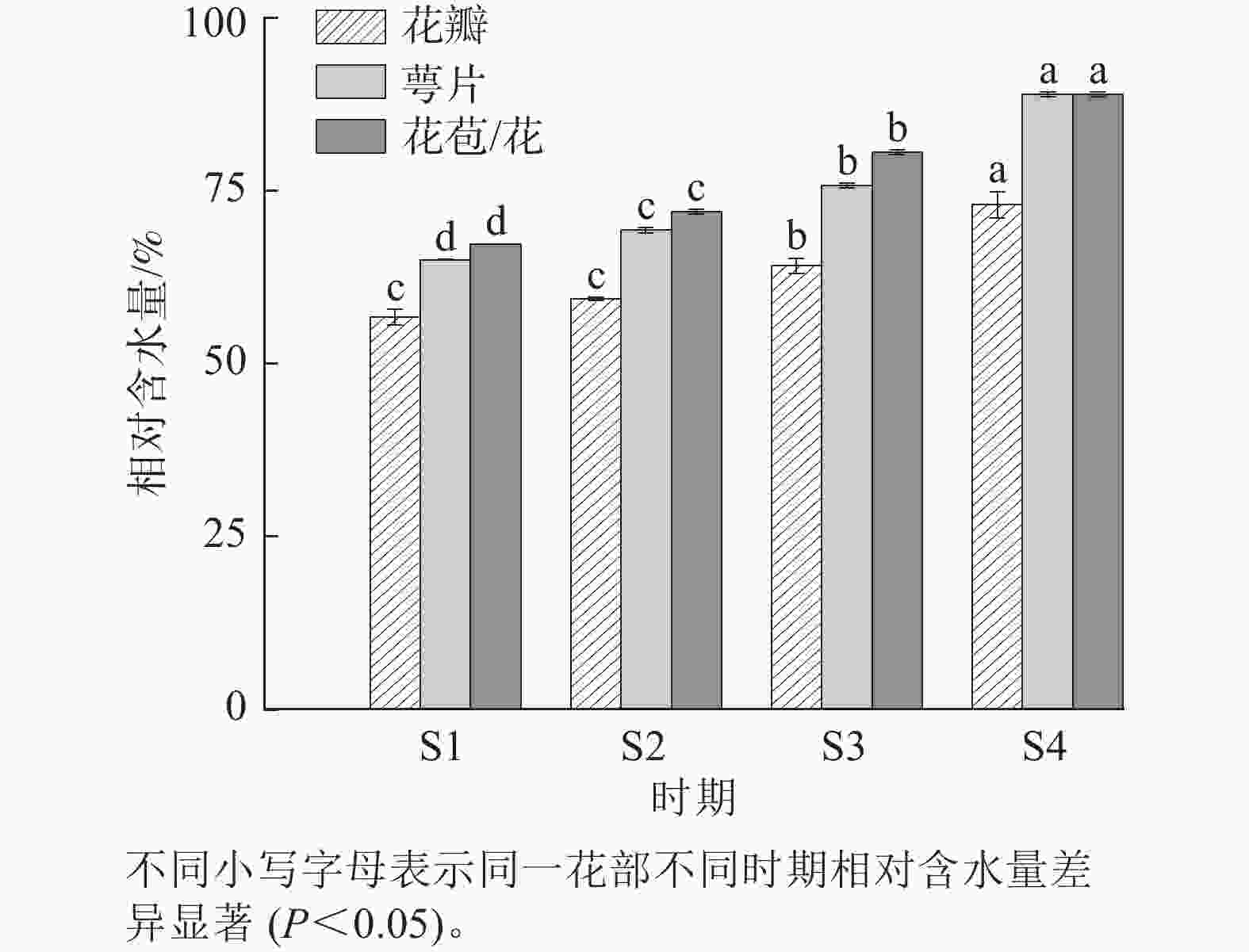
在紫薇花开放过程中,发现花瓣、萼片以及整个花苞/整朵花在紫薇花开放期间的相对含水量整体都呈上升趋势(图3),且都在S4时期达到最高,分别为72.97%、88.97%和88.92%。这表明在开花进程中,花部细胞需要具有较高的含水量以保持其紧张度维持正常开放。4个时期的萼片和整个花苞/整朵花相对含水量表现出显著差异(P<0.05),S1与S2时期花瓣无显著差异。
-
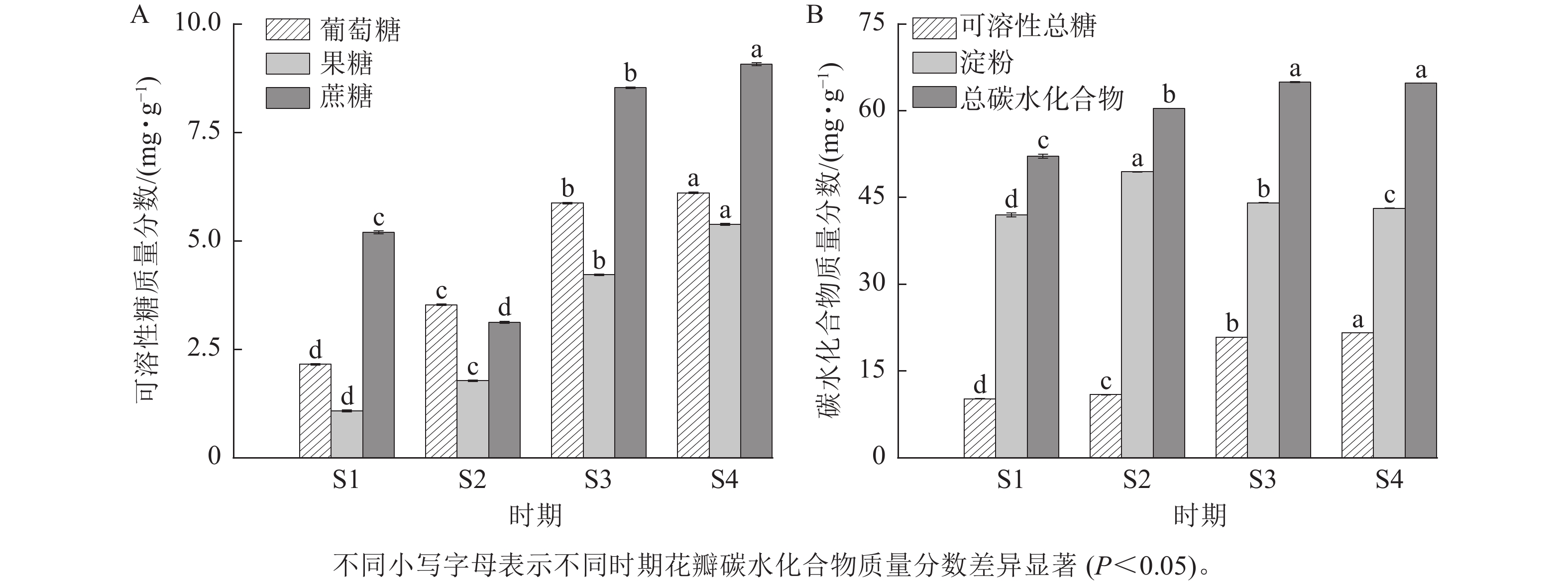
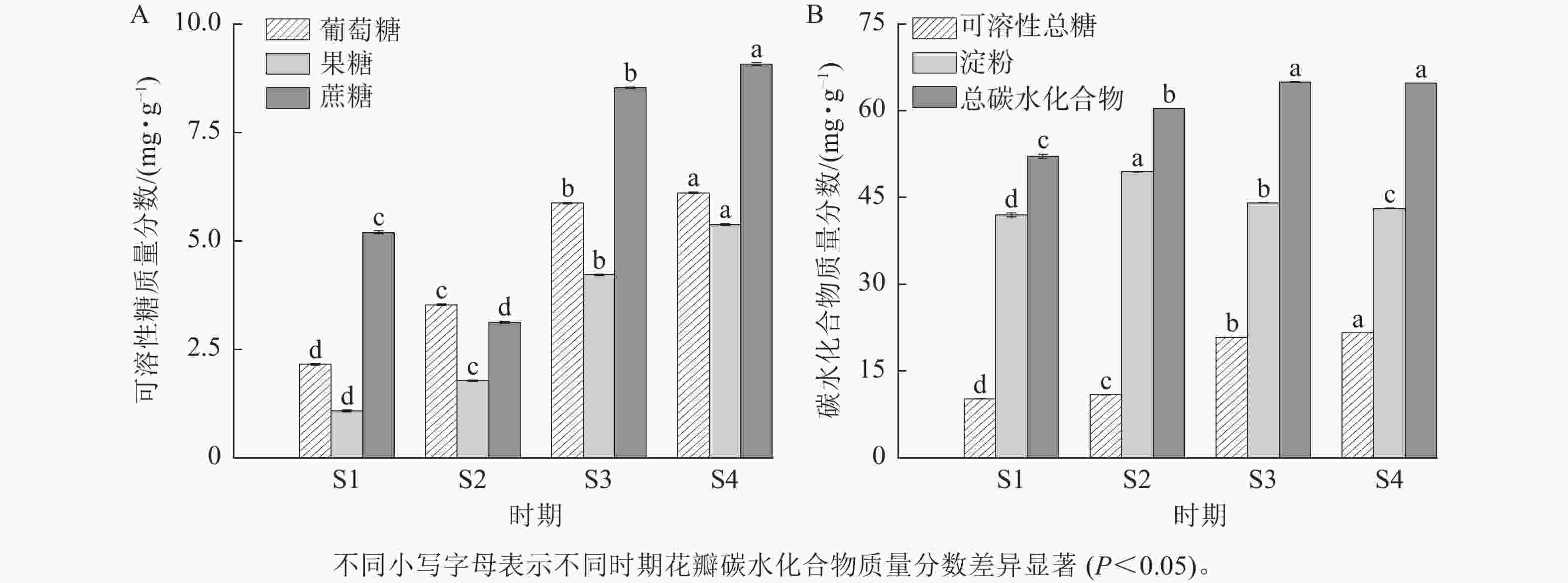
由图4可知:紫薇花开放过程中,葡萄糖、果糖和可溶性总糖质量分数具有类似的变化趋势,从S1到S4时期逐渐上升,其中果糖和可溶性总糖质量分数在S3时期上升幅度较大。紫薇花瓣中蔗糖质量分数呈先下降后上升的趋势,从S3时期开始增加,在S4时期达最大值,为9.07 mg·g−1。淀粉质量分数则呈先上升后下降的趋势,在S1时期质量分数最低,为41.97 mg·g−1。总碳水化合物质量分数在S3与S4时期差异不显著,葡萄糖、果糖、蔗糖、可溶性总糖和淀粉质量分数在4个时期的紫薇花瓣中表现出显著差异(P<0.05)。
-
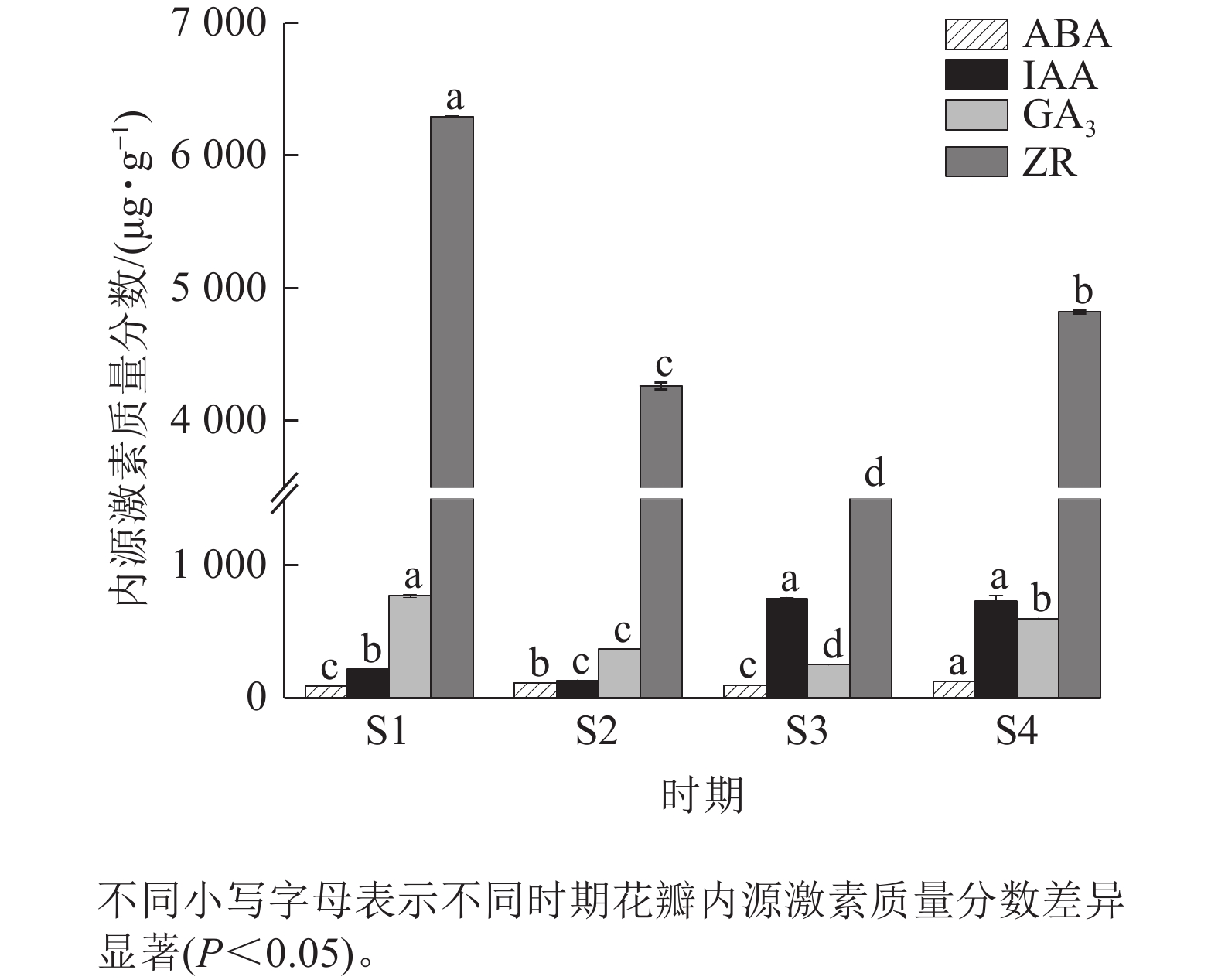
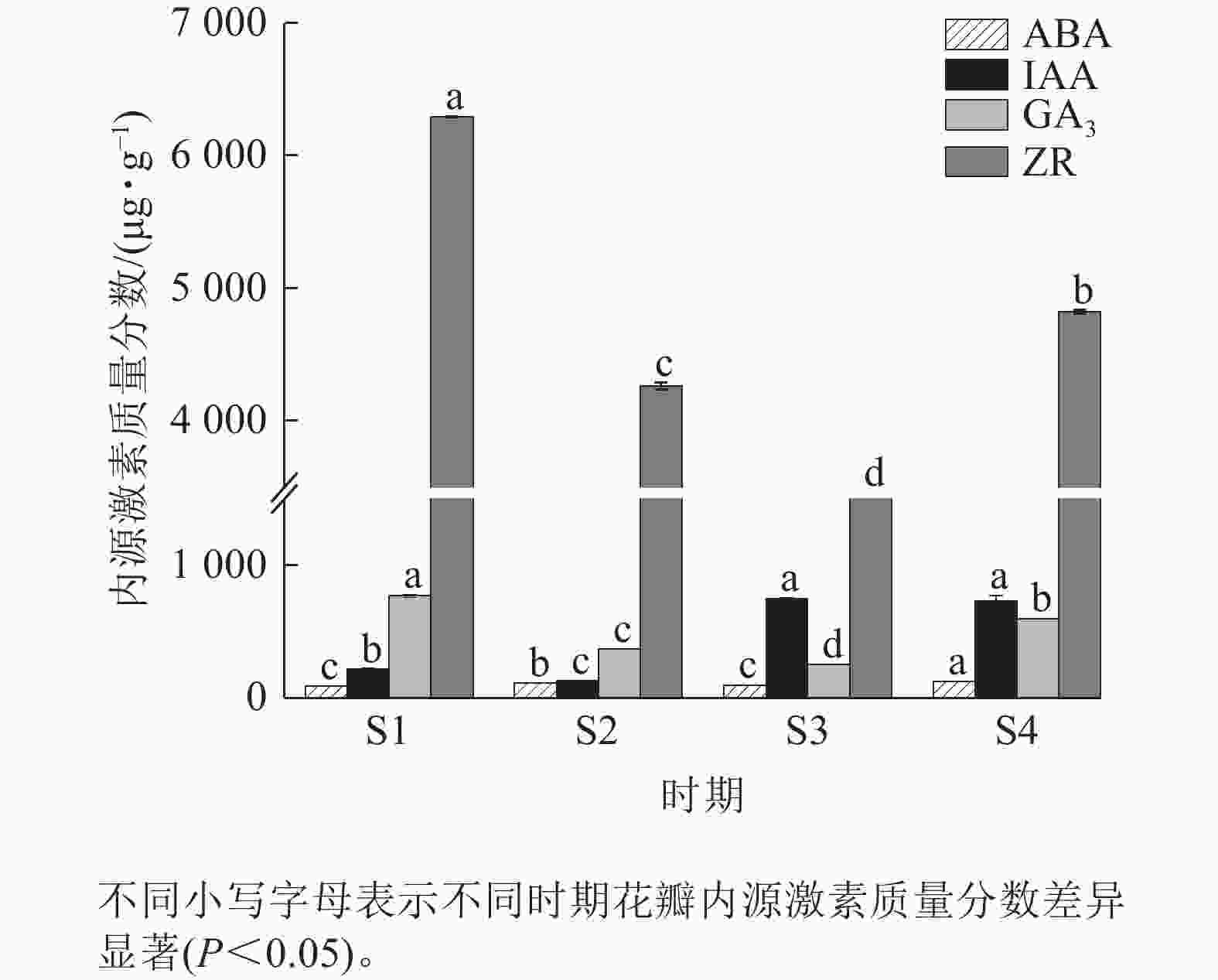
由图5可知:4个时期紫薇花瓣的ZR质量分数最高,ABA质量分数最低。ABA质量分数整体变化不明显,在紫薇开花期间呈“上升—下降—上升”趋势,在S4时期达到最高值,为123.45 μg·g−1。IAA质量分数呈“下降—上升—下降”趋势,在S3时期上升幅度较大,但S3时期与S4时期差异变化不显著。GA3与ZR质量分数变化趋势相似,呈先下降后上升趋势,均在S1时期最高,分别为770.65、6 294.81 μg·g−1。
如表1所示:从S1到S2时期,IAA/ABA逐渐降低,在S2时期降至最低,在S3时期迅速回升,在S4时期又回落。IAA/GA3在S1~S3时期逐渐升高,在S3时期最高,然后到S4时期有所下降。在紫薇花开放过程中,ZR/ABA先降低且降幅较大,在S3到S4时期略回升。ZR/GA3呈先升高后降低的趋势,在S3时期达到峰值,到S4时期又下降。ABA/GA3与ZR/GA3变化类似,均在S1~S3时期有所上升,然后在S4时期回落。
时期 IAA/ABA IAA/GA3 ZR/ABA ZR/GA3 ABA/GA3 S1 2.38 0.29 68.07 8.17 0.12 S2 1.17 0.36 37.90 11.61 0.31 S3 7.83 3.00 32.69 12.52 0.38 S4 5.92 1.22 39.05 8.06 0.31 Table 1. Changes of endogenous hormone ratio during L. indica flower opening
-
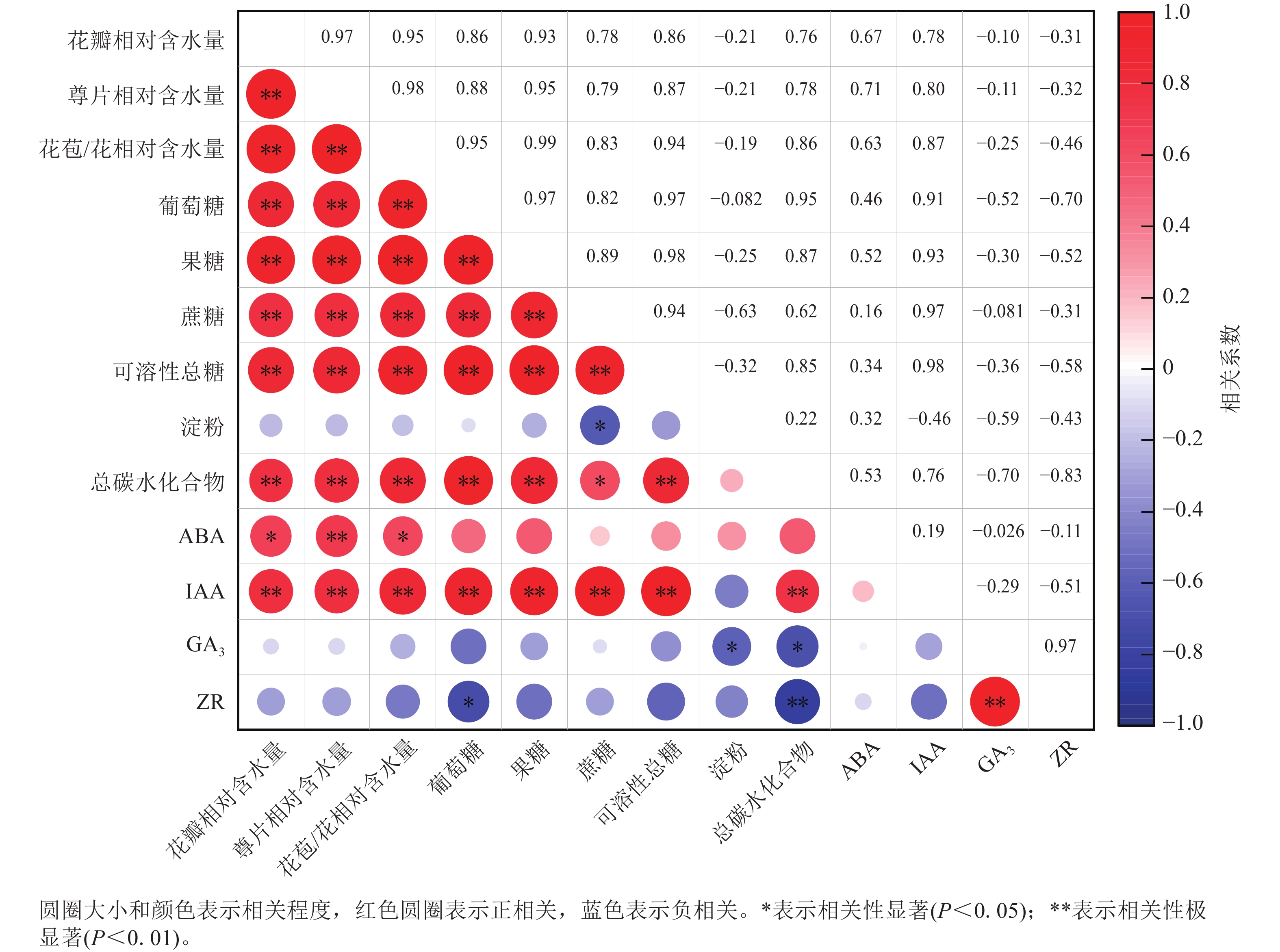
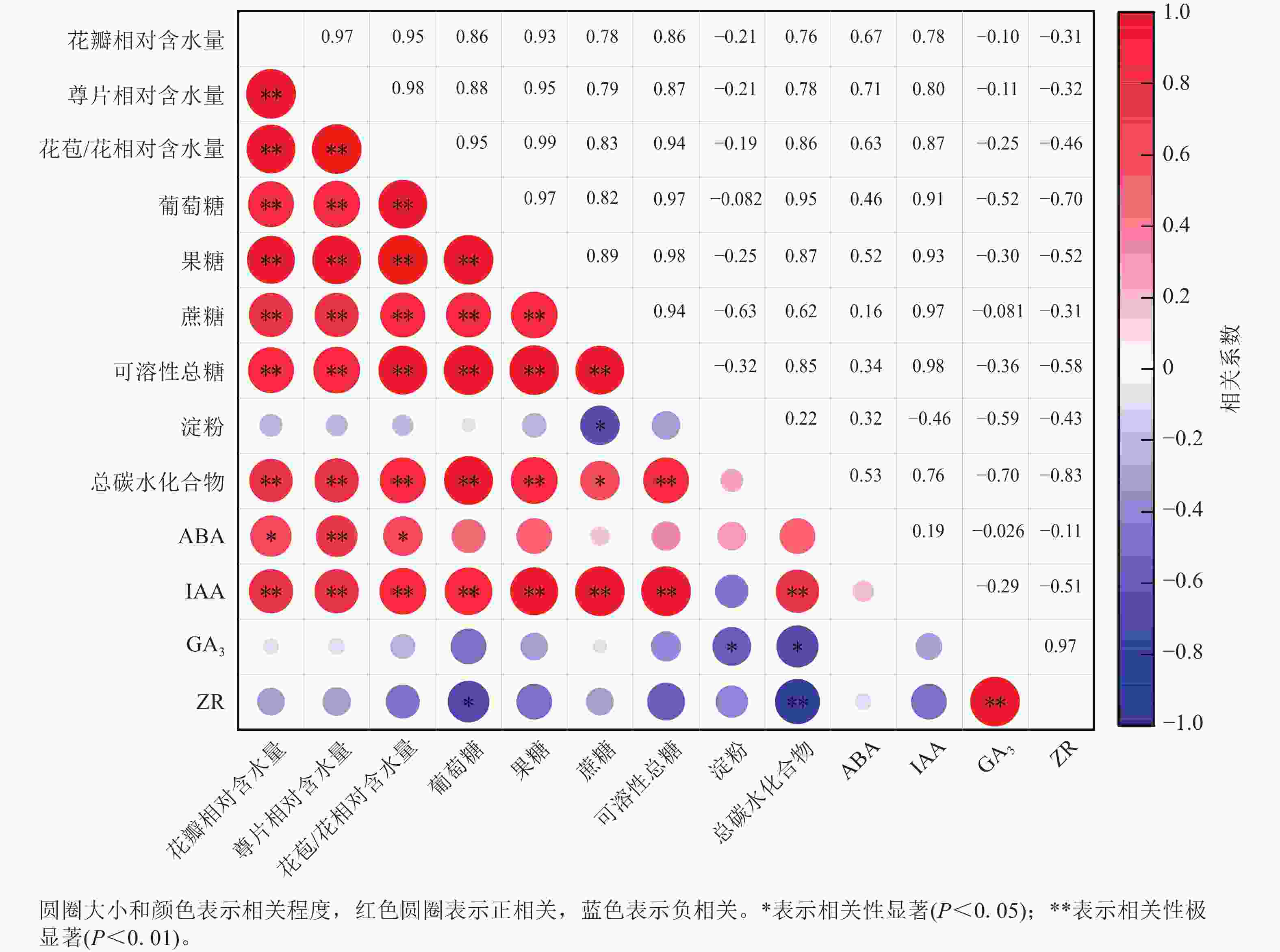
相关性分析(图6)显示:ZR与GA3质量分数呈极显著正相关(P<0.01),相关系数为0.97,与总碳水化合物质量分数呈极显著负相关(P<0.01),相关系数为−0.83。花瓣相对含水量与萼片相对含水量、花苞/花相对含水量、葡萄糖、果糖、蔗糖、可溶性总糖、总碳水化合物以及IAA质量分数呈极显著正相关(P<0.01),相关性系数分别为0.97、0.95、0.86、0.93、0.78、0.86、0.76和0.78,与ABA质量分数呈显著正相关(P<0.05),相关性系数为0.67。淀粉与蔗糖质量分数呈显著负相关(P<0.05),相关系数为−0.46。
-
本研究将紫薇花开放过程分为紧蕾期(S1)、花蕾膨大期(S2)、初开期(S3)和盛开期(S4)等4个时期。利用扫描电镜对紫薇花开放4个时期花瓣上下表皮细胞进行观测,发现细胞形态在花开放过程中有显著变化。在花开放的各个时期,上表皮细胞数量略多于下表皮细胞,这与洋桔梗Eustoma grandiflorum[18]的研究结果一致。上表皮细胞的显著扩张和挤压现象可能增强了花瓣的颜色和质地,提高了对授粉者的吸引力,而细胞表面的不平整可能增加了花瓣的结构稳定性,有助于维持开放状态,便于授粉昆虫的访问[19]。
细胞水分在营养物质的运输以及渗透压的调节中起着关键作用。在开花进程中,含水量高有助于维持花瓣和萼片的紧张度和鲜艳度。相对含水量能够反映植物自身水分状况[20]。随着花开放的进行,紫薇各花部器官细胞的相对含水量均呈逐渐升高的趋势,梅花Armeniaca mume、蜡梅Chimonanthus praecox、江南槐Robinia pseudoacacia f. decaisneana和珍珠梅Sorbaria sorbifolia中也出现类似情况[21−23]。紫薇各花部器官细胞相对含水量增加有助于细胞保持一定的张力,能够促进紫薇花朵的开放。
碳水化合物是植物生长发育过程的重要结构物质和能量供给,其积累和消耗在很大程度上影响着花芽分化的基本进程[24]。碳水化合物主要指糖类物质,其中可溶性糖和可溶性淀粉是植物体内各项生命活动中起主要作用的糖类物质[25]。本研究中,紫薇开花过程中总碳水化合物呈逐渐上升趋势,推测总碳水化合物的积累有利于花芽发育。可溶性总糖作为植物能量的载体,是植物体内碳水化合物运输的主要形式,其质量分数变化能够反映植物体内的碳素营养状况[26]。淀粉是一种碳水化合物,已被证实是呼吸和代谢的中间产物,对植物开花有很大的影响[27−28]。许多物种开花初期花瓣细胞中含有大量淀粉,如百合Lilium spp.[29]和突厥蔷薇Rosa damascena[30]等,它们通过将淀粉转化为葡萄糖和果糖来促进花朵开放。在本研究中,淀粉呈“上升—下降”趋势,由此推测,在紫薇开花过程中淀粉可能转化为可溶性糖,以满足开花过程中代谢能量的需要。
植物激素在调控植物营养生长和生殖发育方面发挥着重要作用,与花芽发育和开花时间密切相关。本研究紫薇开花过程中,ABA总质量分数较少,推测较低水平的ABA有促进开花的作用。IAA质量分数与开花直接相关,在本研究中,IAA质量分数在紫薇开花前期先下降,在S2时期后急剧上升,到S3时期最高,这与日本杏Prunus armeniacal[31]的研究结果相似,推测高水平IAA可能有利于紫薇开花。在四季花金花茶Camellia perpetua[32]中,高水平的GA3和ZR有利于花芽分化,而低水平的GA3和ZR促使花开放。本研究中,GA3和ZR在紫薇开花过程中质量分数相对较高,S3时期最低,推测低水平的GA3和ZR促进紫薇开花。“激素平衡假说”认为:植物开花并非由单一激素决定,而是多种激素相互作用的结果[1]。本研究中随着花开放进行,花瓣中内源激素的比值也在变化。在紫薇花开放前期IAA/GA3高,盛开期内降低,ZR/GA3和ABA/GA3也呈现同样的趋势,所以这暗示了IAA、ZR、ABA与GA3的比值升高可能促进紫薇开花。ZR/ABA相对较高,在紫薇花开放前期比值一直呈下降趋势,推测ZR/ABA较低可以促进花朵绽放,到S3时期又上升,说明ZR/ABA在开花后上升延缓花瓣衰老,这与金花茶C. petelotii[33]的研究结果一致。此外,紫薇花瓣中IAA/ABA在S2到S3时期呈上升趋势,说明紫薇花瓣中IAA/ABA的升高可促进花朵绽放。
紫薇花开放过程中,花瓣相对含水量、萼片相对含水量、花苞/花相对含水量、葡萄糖、果糖、蔗糖、可溶性总糖、总碳水化合物以及IAA质量分数等9个指标呈极显著正相关,淀粉、GA3和ZR与大部分指标间的相关性不显著。
-
本研究基于物候观测,将紫薇单花开放过程分为4个时期,发现在紫薇花开放过程中花瓣上下表皮细胞逐渐变大,花部细胞相对含水量逐渐升高、碳水化合物质量分数和内源激素质量分数发生动态变化。未来可进一步探究内源激素的水平和比例、非生物胁迫等条件对紫薇花开放的影响和各器官内各物质的分配变化规律,以优化紫薇花开放进程,便于花期调控。
Physiological characteristics of Lagerstroemia indica flowers in opening process
doi: 10.11833/j.issn.2095-0756.20240347
- Received Date: 2024-05-14
- Accepted Date: 2024-12-06
- Rev Recd Date: 2024-10-27
- Available Online: 2025-04-01
- Publish Date: 2025-04-01
-
Key words:
- Lagerstroemia indica /
- flower opening /
- physiological mechanisms /
- endogenous hormones
Abstract:
| Citation: | CHEN Mengmeng, ZHAO Yu, BAI Mingzhu, et al. Physiological characteristics of Lagerstroemia indica flowers in opening process[J]. Journal of Zhejiang A&F University, 2025, 42(2): 339−347 doi: 10.11833/j.issn.2095-0756.20240347 |










 DownLoad:
DownLoad: