-
苦荞Fagopyrum tataricum是一种既可食用又可药用的粮食作物,喜旱怕水,在中国西南部高海拔地区广泛种植[1−2],其籽粒含有抗性淀粉(RS)和γ-氨基丁酸(GABA)等功能性成分,对预防和治疗慢性疾病具有特殊功效和巨大药用价值,有较高的营养和医疗保健价值[3],成为功能性食品开发和研究的热点之一[4]。RS主要指不能被健康人体小肠所吸收的部分淀粉及其降解产物的总和[5]。食用富含RS的食物有助于增加饱腹感,减少热量摄入[6],且引起的血糖波动较小,有助于控制血糖浓度。对于苦荞中RS的研究主要集中在RS的制备,如利用高压糊化、多次湿热处理等制备苦荞RS[7]。淀粉合成酶(SS)主要有颗粒结合淀粉合成酶(GBSS)和可溶性淀粉合成酶(SSS) 2种,是淀粉生物合成过程中的关键酶之一[8],WANG等[9]从苦荞基因组中鉴定了15个SS基因家族成员,对其分子特征进行了分析,WANG等[10]分析了苦荞淀粉颗粒结合酶基因(FtGBSSI)完整的基因组序列。GABA是一种广泛分布于动物、植物和微生物体内的非蛋白氨基酸[11],可作为应激反应信号参与植物的抗逆性调节,也可作为神经递质,参与动物神经元的兴奋和抑制调节,帮助改善睡眠,缓解抑郁和焦虑[11−13]。外源摄入GABA还具有降血脂、预防肥胖症等功能[14−15]。对于苦荞中GABA的研究主要集中在富集、功能性食品应用等方面,张钰等[16]利用柠檬酸和亚精胺联合处理提高了苦荞芽中GABA的含量,CHEN等[17]使用冷常压等离子体促进苦荞籽粒中GABA的积累。
数量性状位点(QTL)定位是揭示复杂数量性状和鉴定候选基因的有效植物育种方法[18−19]。在不同的遗传背景下挖掘QTL对植物育种具有重要价值。RS和GABA作为植物重要的功能性成分,挖掘与其相关的QTL,了解其遗传基础对提高作物产量和优化作物品质具有重要意义。近年对RS和GABA的QTL研究多集中在水稻Oryza sativa等[20]农作物中,目前还没有对苦荞籽粒中RS和GABA的QTL报道。
本研究以父本‘晋荞麦2号’‘Jinqiaomai No. 2’、母本‘小米荞’‘Xiaomiqiao’及其构建的重组自交系(XJ-RILs)群体为供试材料,基于黎瑞源等[21]构建的遗传图谱,对XJ-RILs群体的RS和GABA 2个功能成分进行QTL定位研究,以期鉴定控制苦荞RS和GABA的关键QTL,通过生物信息学分析找到相关的候选基因,探索这2个功能成分在苦荞中的遗传基础,为苦荞品种遗传改良及精确定位RS和GABA含量相关的基因提供基础材料。
-
父本‘晋荞麦2号’、母本‘小米荞’及其构建的XJ-RILs群体于2022年种植于贵州师范大学荞麦产业技术研究中心安顺基地,常规大田管理。成熟期收获籽粒,在30 ℃烘箱中烘干后剥壳,磨粉,存放于4 ℃冰箱备用。取‘晋荞麦2号’和‘贵米苦11号’‘Guimiku No. 11’根、茎、叶、花、籽粒等不同部位组织,用液氮速冻后存放于−80 ℃冰箱备用。
-
参考张焕新[22]的方法,略有改动,试剂购自伯远生物。准确称取0.100 0 g 样品,添加3 mL HCl-KCl (pH 2~3)缓冲液,加入1 mL胃蛋白酶,60 ℃水浴振荡1.0 h。取出冷却后用HCl和NaOH调pH至5.4,加入2 mL α-淀粉酶,90 ℃水浴振荡1.5 h。样品冷却至室温整pH为4.1~4.3,加入1 mL葡萄糖淀粉酶,60 ℃水浴振荡2.0 h。加入10 mL无水乙醇,10 000 r·min−1离心2 min;弃去上清液,沉淀用80%乙醇洗3遍;加入2 mL KOH溶解沉淀,调整pH至4.1~4.3,加入1 mL葡萄糖淀粉酶,60 ℃水浴振荡1.0 h;沸水浴5 min,10 000 r·min−1离心2 min,收集上清液,加3 mL ddH2O洗涤沉淀2次,上清液合并,定容至15 mL(待测样)。使用二硝基水杨酸(DNS)法在540 nm处测定吸光度[D(540)],根据公式计算RS质量分数:RS质量分数=(葡萄糖质量×0.9/样品淀粉质量)×待测样体积×100%。
-
参考王传蔚[23]的方法,略有改动,试剂购自伯远生物。准确称取0.100 0 g样品,加入4 mL甲醇,室温振荡10 min;5 000 r·min−1离心15 min,弃上清液;重复上述甲醇处理步骤1次,待沉淀完全干燥后,加入4 mL ddH2O,40 ℃水浴振荡10 min,5 000 r·min−1离心15 min,取上清液备用;重复上述步骤1次,合并上清液,定容至10 mL。取2 mL溶液加入0.8 mL 0.5 mol·L−1 AlCl3,室温振荡5 min,12 000 r·min−1离心5 min,弃沉淀;加入1.2 mL的10.5 mol·L−1 KOH,室温振荡5 min,12 000 r·min−1离心5 min,取上清液备用;重复上述步骤,直至将10 mL提取液全部处理完毕,合并所有得到的上清液;加入4 mL的四硼酸钠缓冲液(pH 8.0)和1.4 mL的质量分数为6%苯酚溶液;缓慢滴加2.5 mL质量分数为5%NaCIO溶液,水浴20 min;定容至50 mL后在625 nm处测定吸光度[D(625)]。根据公式计算样品GABA质量分数:GABA质量分数=待测液中总GABA质量浓度×待测液的体积×样品的总稀释倍数/(样品的质量×106)×1 000‰。
-
使用WinQTLCart 2.5的复合区间作图法(CIM),设置对数优势比(LOD)为2.5,对XJ-RILs群体进行QTL分析,采用“q+性状英文名缩写+所在染色体编号+序列号”对QTL位点进行命名[24]。
-
基于XJ-RILs群体的SNP遗传图谱定位到控制RS和GABA相应的物理区间[25],将各QTL物理区间对应苦荞‘品苦1号’‘Pinku No. 1’参考基因组(https://www.mbkbase.org/Pinku1/)以获得QTL区间内基因及注释信息[26]。
-
使用RNA Easy Fast植物组织RNA快速提取试剂盒(天根生化公司)提取‘贵米苦11号’和‘晋荞麦2号’不同组织的RNA,使用PrimeScriptTMRT Master Mix(TaKaRa生物公司)反转录成cDNA,选择了FtPinG0008597700.01、FtPinG0007011200.01、FtPinG0008803200.01和FtPinG0008811900.01等4个候选基因用Primer3 Plus设计RT-qPCR引物,由生工生物工程有限公司合成(引物序列见表1),内参基因为FtActUniv。以‘贵米苦11号’和‘晋荞麦2号’不同组织的cDNA为模板,按照Eastep qPCR Mix(2x)试剂盒(普洛麦格生物公司)说明书进行RT-qPCR。采用2−∆∆Ct法计算候选基因的表达量。
引物 正向引物(5′→3′) 反向引物(5′→3′) q-FtPinG0008597700.01 GCGAACTATGGAGGGCTTGT TCGTGCTCAGCCTGAAAAGT q-FtPinG0007011200.01 CCATCATCAACTGGCTTCGG GCAACAGAATTCACAAGGGACG q-FtPinG0008803200.01 TTCAGAATCCCAAGTCCGGC ATGAGGGGACAGAGACGTCA q-FtPinG0008811900.01 GTTTGTTCAGGTGGCAGTCG CCTGCAAGTAGAAGGGCACA ActUniv GAGTTATGAGCTTCCTGATG CCGCCACTCAACACAATGTT Table 1. Primers used for RT-qPCR analysis
-
利用Excel 2019计算均值和变异系数,采用IBM SPSS Statistics 26计算峰度、偏度、绘制频率分布图和进行各类群间研究性状的方差分析;采用RStudio应用程序作聚类分析,采用iTOL工具绘制聚类图[27]。
-
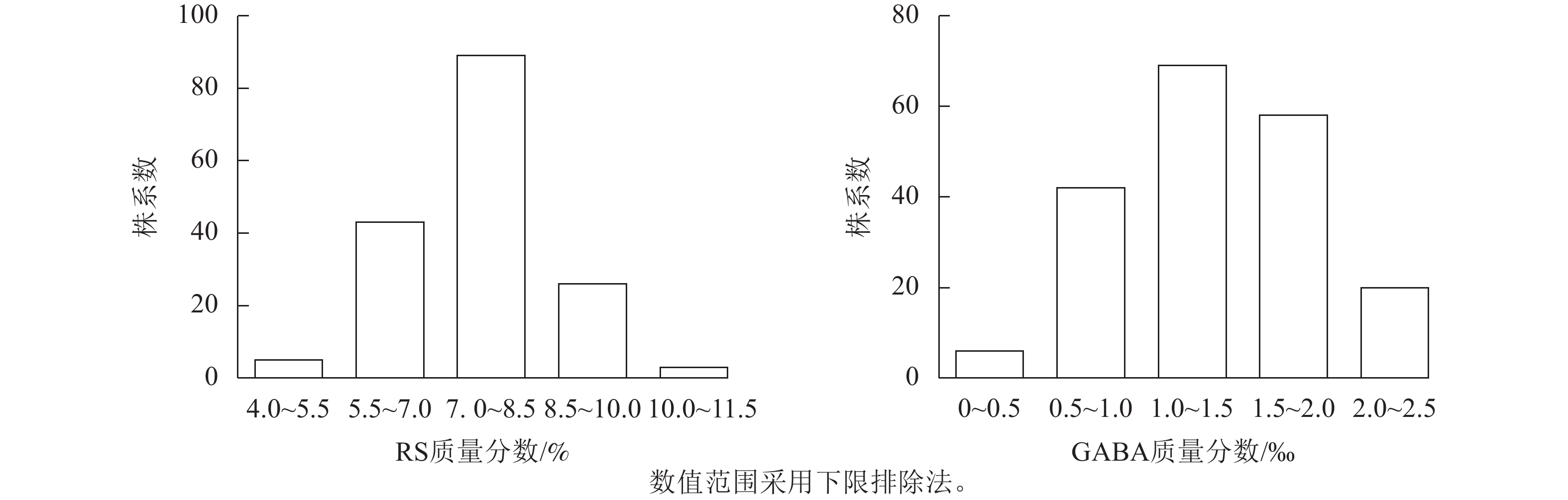
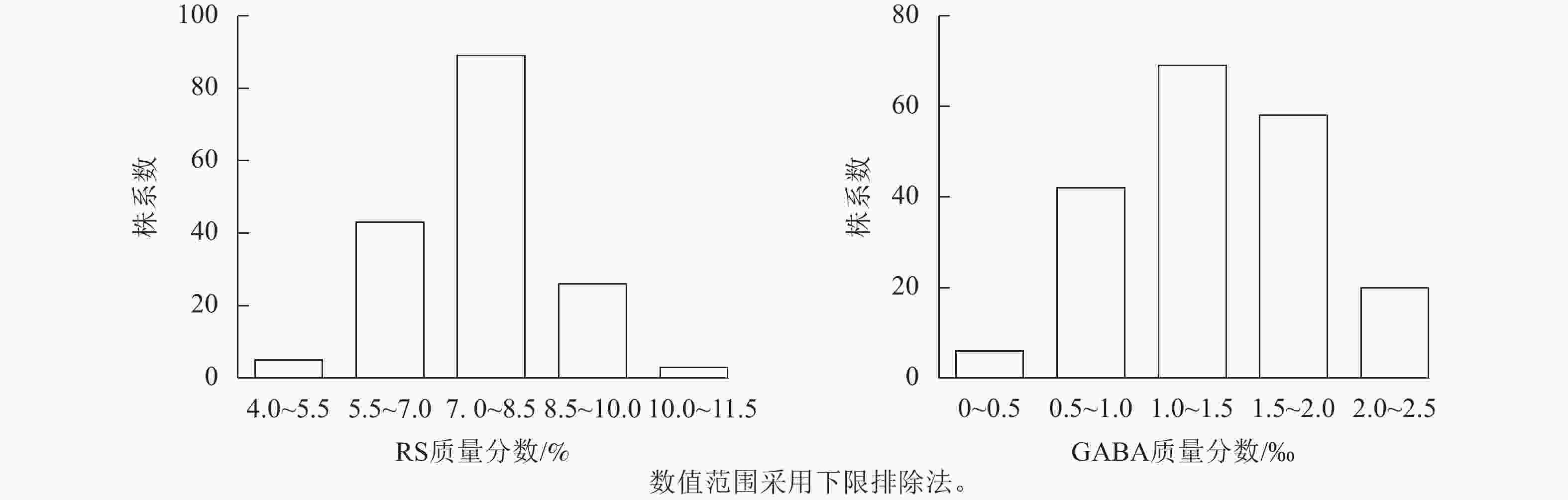
苦荞XJ-RILs群体亲本‘晋荞麦2号’和‘小米荞’RS质量分数分别为8.84%和9.26%,GABA质量分数分别为0.50‰和0.56‰(表2),双亲间差异不显著;XJ-RILs群体RS和GABA质量分数分别为4.51%~10.52%和0.37‰~2.50‰,平均值分别为7.53%和1.35‰,变异系数分别为14.43%和38.21%(表2),均表现为偏正态分布,具超亲优势(图1),偏度分别为0.123和0.018,峰度分别为0.179和−0.875 (表2),表明这2种性状均是由多基因控制的数量性状。
样本 RS GABA 平均值±标准差/% 范围/% 偏度 峰度 变异系数/% 平均值±标准差/‰ 范围/‰ 偏度 峰度 变异系数/% ‘晋荞2号’ 8.84±0.41 0.50±0.15 ‘小米荞’ 9.26±0.35 0.56±0.04 XJ-RILs 群体 7.53±1.09 4.51~10.52 0.123 0.179 14.43 1.35±0.52 0.37~2.50 0.018 −0.875 38.21 Table 2. Descriptive statistical analysis of RS and GABA in the XJ-RILs population of Tartary buckwheat and the parents
-
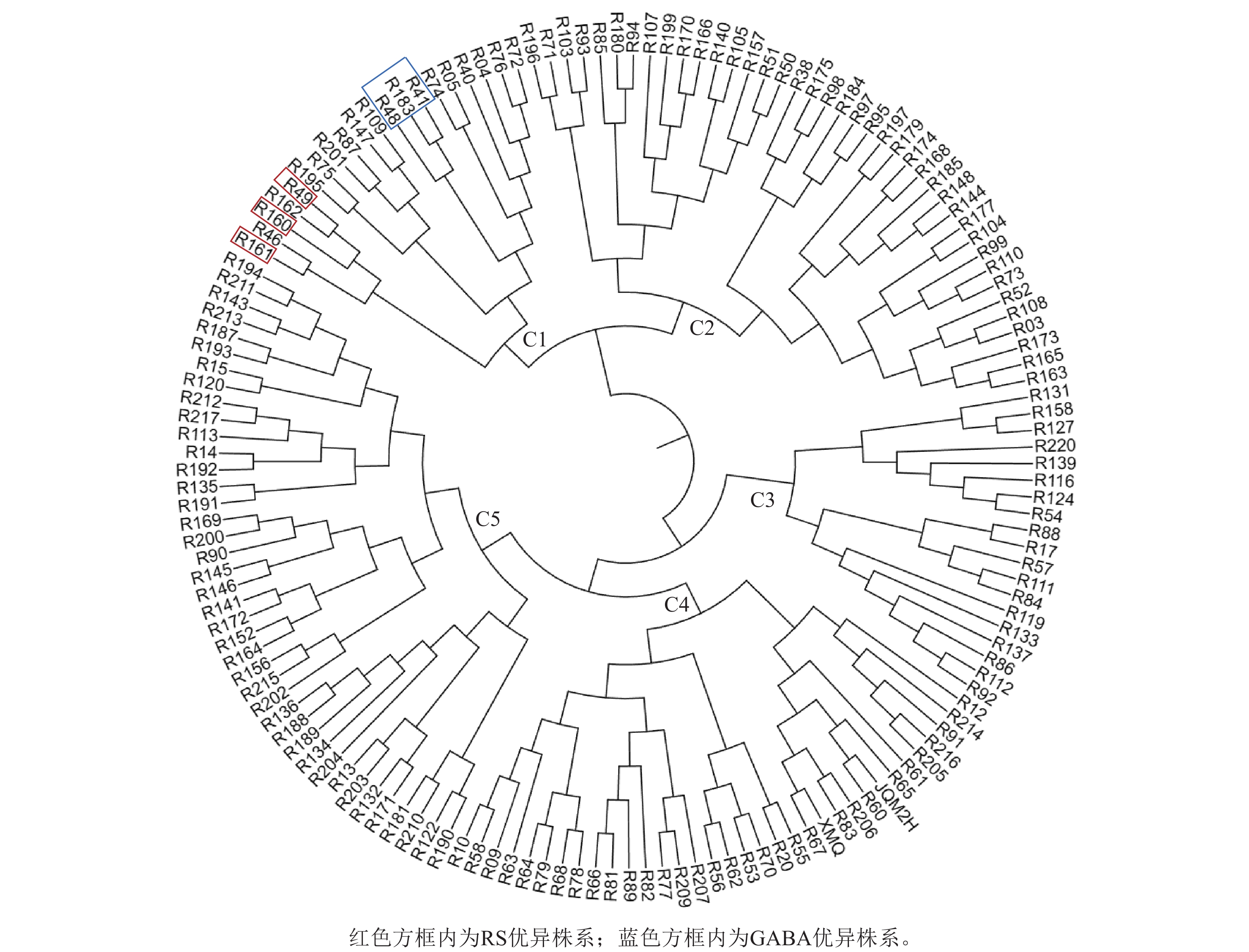
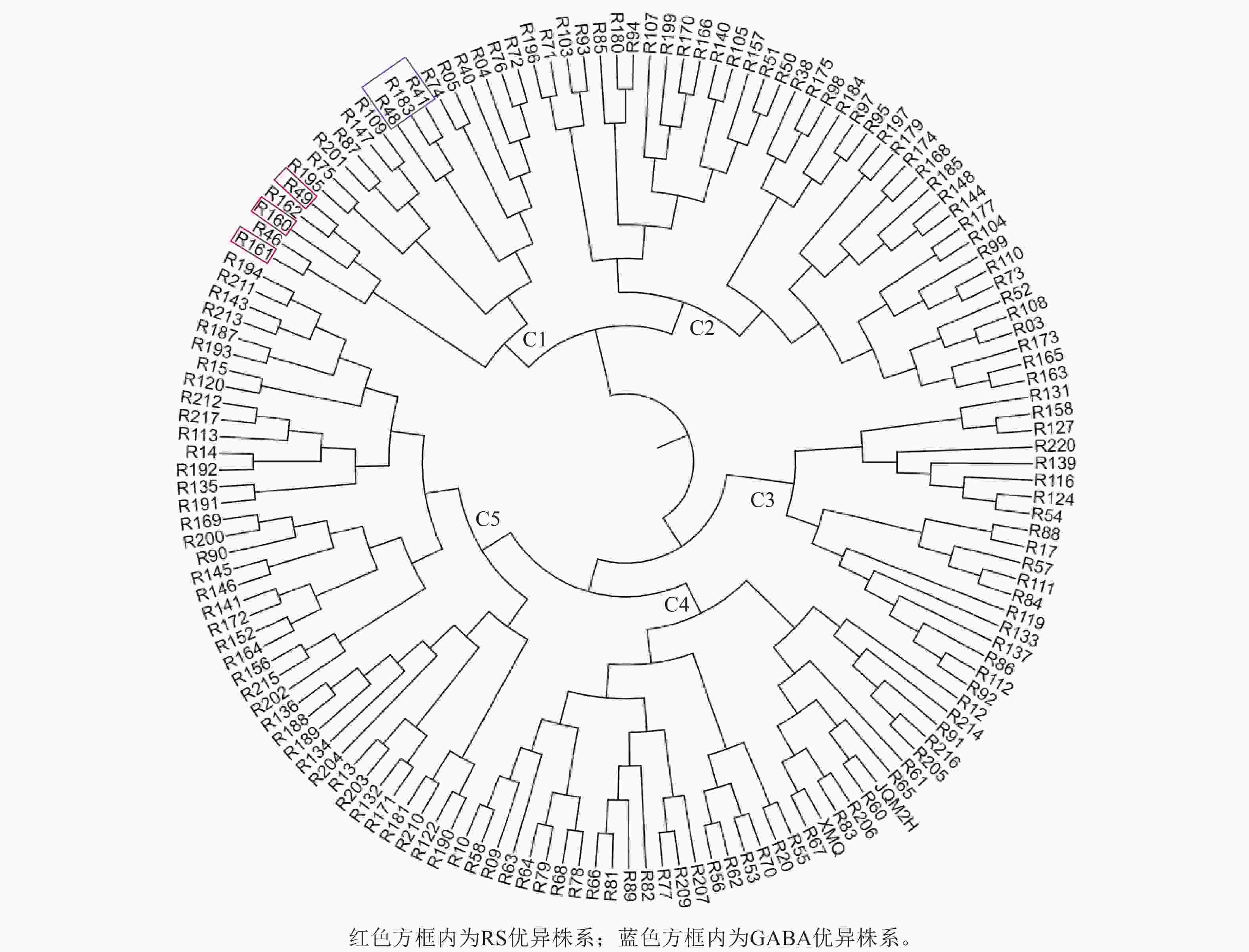
根据RS和GABA的质量分数对苦荞XJ-RILs群体及其亲本共计153个株系进行聚类分析。结果表明:153个株系被分为5个类群(图2),C1类群包含20个株系,RS平均质量分数为8.78%,GABA平均质量分数为1.99‰,均高于其他4个类群(表3);C2类群包含40个株系,RS平均质量分数为6.89%,GABA平均质量分数为1.83‰;C3类群包含19个株系,较其他4个类群最少,RS质量分数也最低,为6.00%,GABA平均质量分数为1.00‰;C4类群包含34个株系,RS平均质量分数为8.27%,GABA质量分数最低,为0.69‰;C5类群包含40个株系,RS平均质量分数为7.71%,GABA平均质量分数为1.26‰。
类群 株系数/个 RS质量分数/% GABA质量分数/‰ C1 20 8.78±0.72 a 1.99±0.27 a C2 40 6.89±0.62 d 1.83±0.20 b C3 19 6.00±052 e 1.00±0.22 d C4 34 8.27±0.97 b 0.69±0.24 e C5 40 7.71±0.46 c 1.26±0.14 c 说明:不同小写字母表示差异显著(P<0.05)。 Table 3. ANOVA analysis of RS and GABA among different groups in XJ-RILs population
从XJ-RILs群体中筛选出R49、R160和R161 3个RS优异株系可作为RS高含量的推荐材料,其RS质量分数分别为9.93%、10.52%和9.91% (表4);从XJ-RILs群体中筛选出GABA表达优异的3个株系可作为GABA高含量的推荐材料,即R41、R48和R183,其GABA质量分数分别为2.39‰、2.50‰和2.47‰ (表4)。
株系 RS质量分数/% GABA质量分数/‰ R41 8.20 2.39 R48 8.75 2.50 R49 9.93 2.00 R160 10.52 1.91 R161 9.91 1.73 R183 8.23 2.47 Table 4. Contents of RS and GABA in excellent lines of XJ-RILs
-
对XJ-RILs群体苦荞籽粒RS和GABA进行QTL定位,RS共检测到2个QTL位点,即qRS3-1和qRS4-1;GABA检测到1个QTL位点,即qGABA7-1。qRS3-1位于第3染色体Block5310~Block5518区间,表型贡献率(R2)为7.59%,LOD为3.2;qRS4-1位于第4染色体Block9147~Block9171区间,R2为6.34%,LOD为2.82;qGABA7-1位于第7染色体Block14135~Block14149区间,R2为5.05%,LOD为1.01;其中qRS3-1和qRS4-1来自‘小米荞’,加性效应分别为−0.31和−0.28,qGABA7-1来自于‘晋荞麦2号’,加性效应为0.11 (表5)。
性状 QTL 染色体 位置/cM LOD R2/% 加性效应 置信区间/cM 标记区间 物理区间/Mb RS qRS3-1 Chr 3 0.39 3.20 7.59 −0.31 38.7~44.0 Block5310~Block5518 12.17~14.26 qRS4-1 Chr 4 1.66 2.82 6.34 −0.28 165.1~168.9 Block9147~Block9171 50.92~51.33 GABA qGABA7-1 Chr 7 1.01 2.52 5.05 0.11 98.9~101.8 Block14135~Block14149 32.352~33.13 说明:LOD. 对数优势比;R2. 表型贡献率。 Table 5. QTL mapping of RS and GABA content in the XJ-RILs population of Tartary buckwheat
-
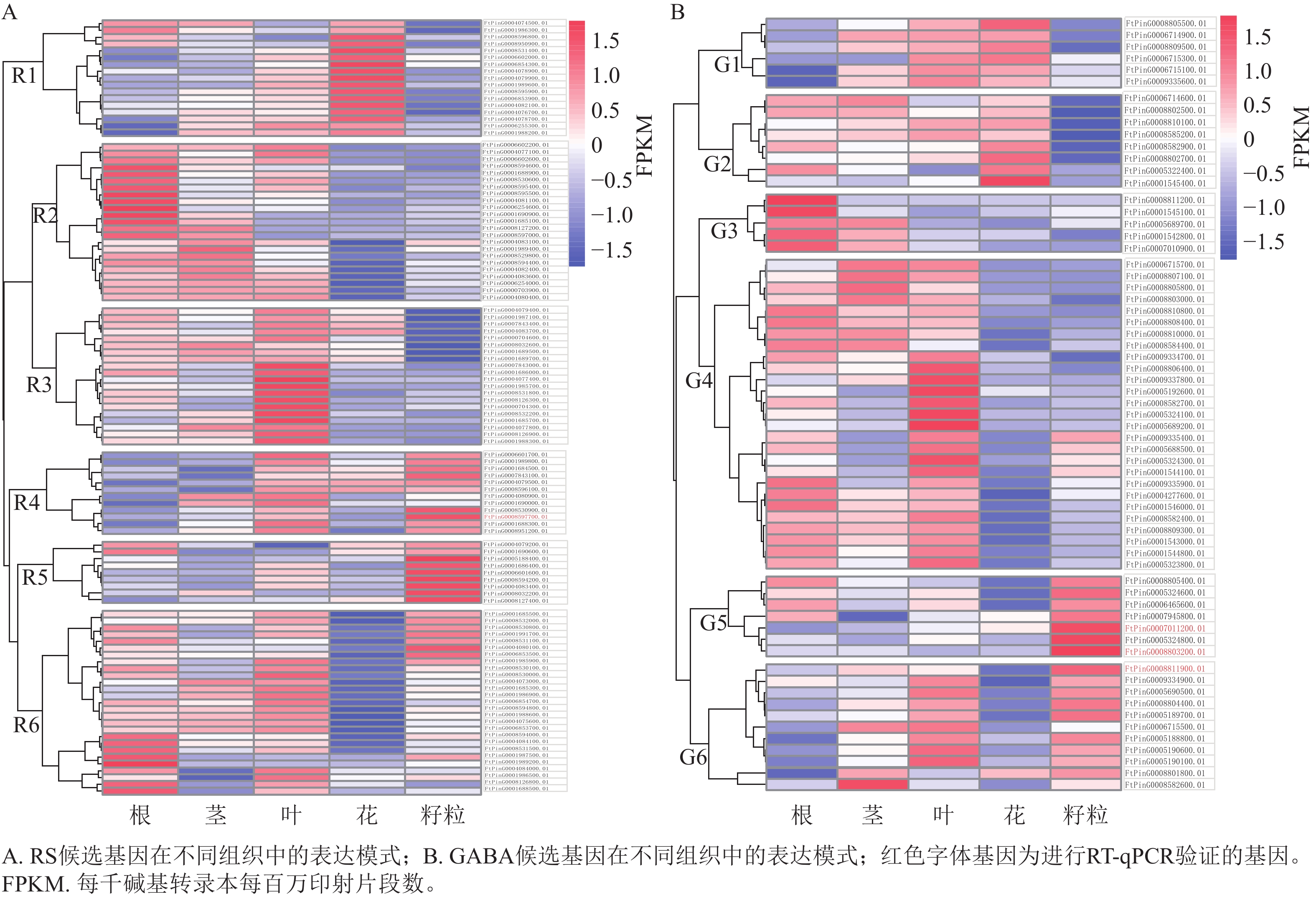
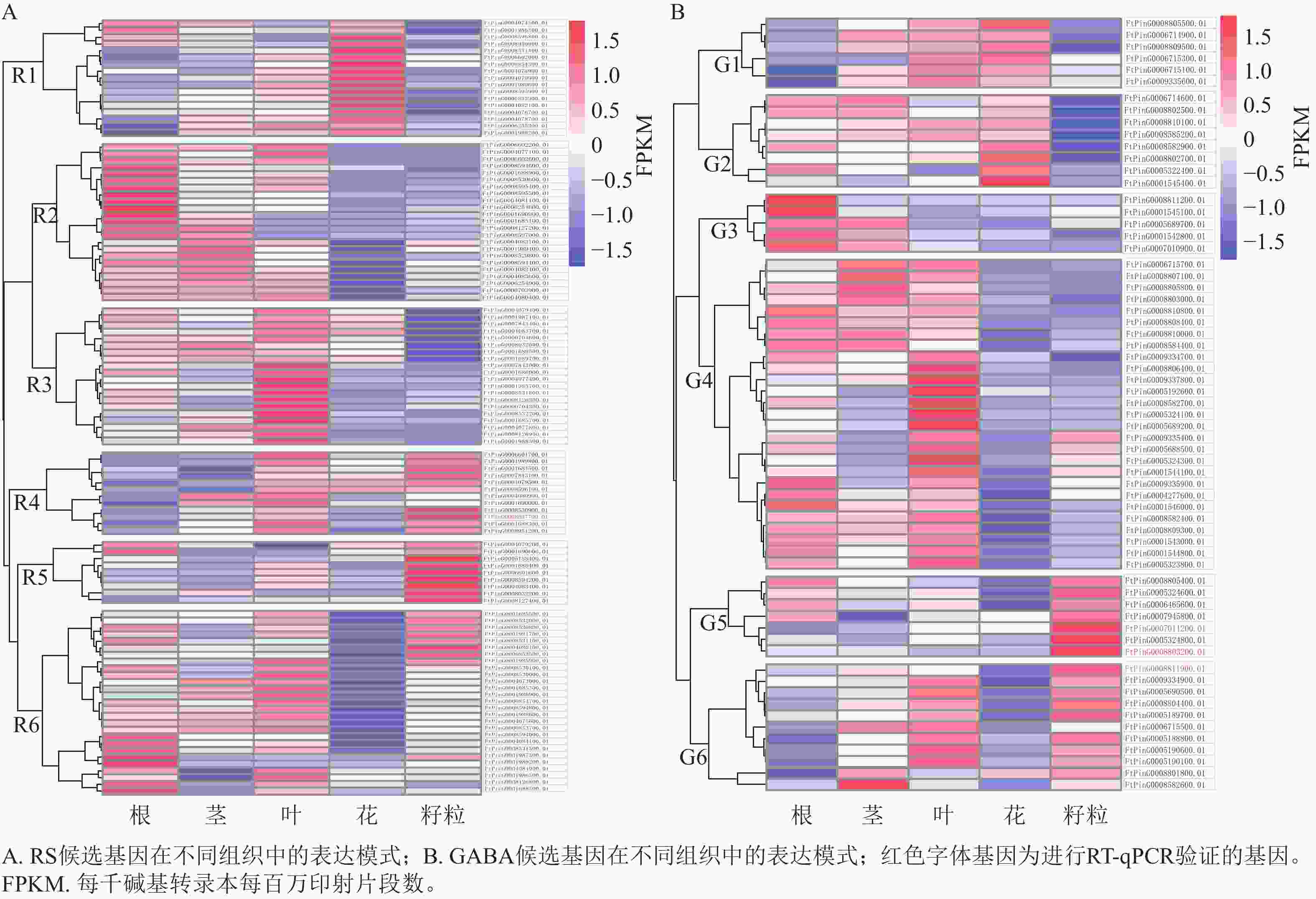
对QTL区段内的候选基因进行检测,qRS3-1、qRS4-1和qGABA7-1分别检测到96、20和70个基因。基于转录组数据,3个QTL位点中有172个基因在苦荞根、茎、叶、花和籽粒等至少一种组织中表达,其表达模式如图3所示。根据RS相关候选基因的表达情况,将在苦荞组织中表达的108个基因聚为6个类群(图3A),即R1~R6。其中,R1类群含17个基因,该类群内基因在花中表达量最高,茎和叶次之,根中相对较低,籽粒中最低;R2类群含23个基因,除FtPinG0004083100.01基因在籽粒中表达量较高外,其余基因在根中表达量最高,茎和叶中次之,籽粒中表达量较低,花中最低;R3类群含20个基因,该类群内基因在叶中表达量最高,在根、茎和花中表达量次之,在籽粒中表达量最低;R4类群含12个基因,除FtPinG0004080900.01和FtPinG0001690000.01基因在籽粒中表达量较低外,其余基因在叶和籽粒中表达量最高,茎和花中表达量次之,根中表达量最低;R5类群含9个基因,该类群内基因在籽粒中表达量最高,在其余各组织中表达量相对较低;R6类群含27个基因,除11个基因在籽粒中表达较高外,其余基因在根和叶中表达量较高,茎和籽粒中次之,花中最低。根据各类群基因在籽粒中的表达情况,R4 (10个)、R5 (9个)和R6 (11个)中的30个基因可能参与籽粒中RS合成。
根据GABA相关候选基因的表达情况,将在苦荞组织中表达的64个基因划分为6个类群(图3B),即G1~G6。其中,G1类群含6个基因,该类群内基因在花和叶中表达量最高,茎中次之,根和籽粒中最低;G2类群含8个基因,该类群内基因在花中表达量最高,根、茎和叶中次之,在籽粒中表达量最低;G3类群含5个基因,该类群内基因在根中表达量最高,在茎中表达量次之,在叶、花和籽粒中表达量较低;G4类群含27个基因,除FtPinG0009335400.01、FtPinG0005688500.01、FtPinG0005324300.01和FtPinG0001544100.01 这4个基因在籽粒中表达量较高外,其余基因在根和叶中表达量最高,茎中次之,在花和籽粒中较低;G5类群含7个基因,该类群内基因在籽粒中表达量最高,根中次之,茎、叶和花中均较低;G6类群含11个基因,除FtPinG0006715500.01在籽粒中表达量较低外,其余基因在籽粒中表达量最高,叶中次之,其次在茎中表达量也较高,在根和花中表达量最低。根据各类群基因在籽粒中的表达情况,G4 (4个)、G5 (7个)、G6 (10个)中的21个基因可能参与籽粒中GABA的合成。
-
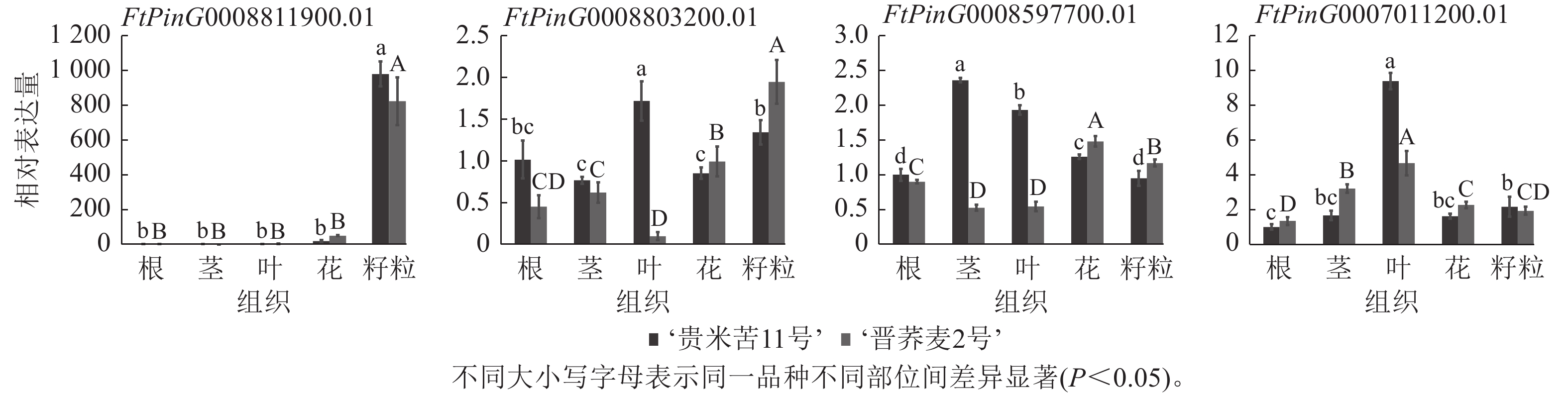
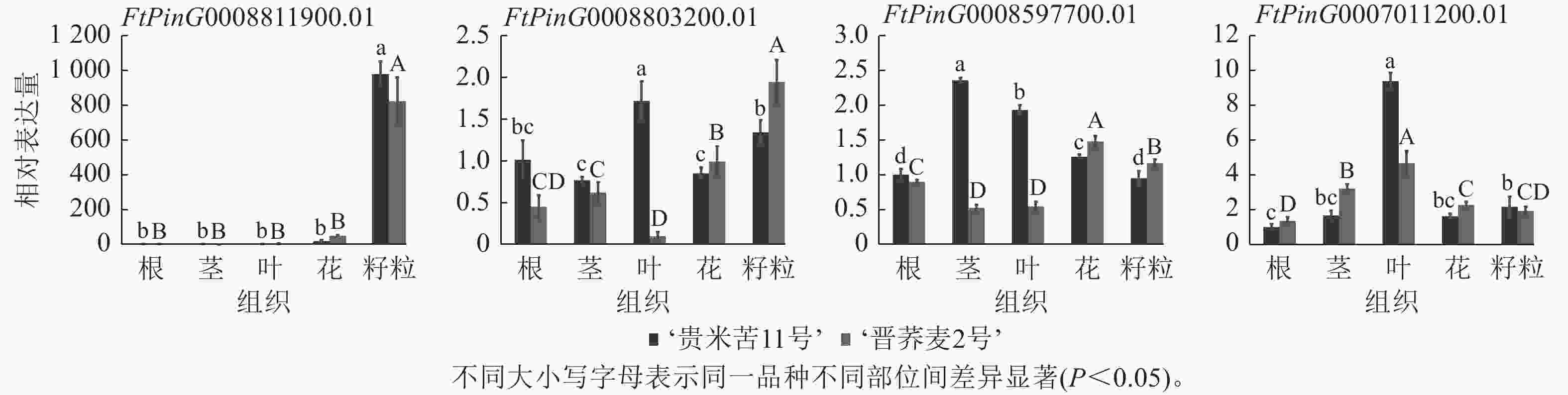
为了确认基于苦荞RNA-seq所作QTL区段内基因组织特异性的准确性,选择了FtPinG0008597700.01、FtPinG0007011200.01、FtPinG0008803200.01和FtPinG0008811900.01等4个在籽粒中高表达的候选基因进行RT-qPCR验证(图4)。基于‘品苦1号’转录组数据对候选基因所作表达模式分析与实际表达情况存在差异,FtPinG0008811900.01在2个品种的不同组织中表达模式与转录组一致,均在籽粒中表达量最高;FtPinG0008803200.01在‘晋荞麦2号’的不同组织中表达量基本与转录组数据一致,但在‘贵米苦11号’的不同组织中表达情况与转录组存在较大差异;FtPinG0008597700.01和FtPinG0007011200.01基因在2个品种中的实际表达量与转录组表达情况均存在差异,但与转录组数据一致的是4个基因在籽粒中均高表达。可见,基因的表达情况会受到遗传背景和环境因素的影响,但基于转录组在籽粒中高表达的基因实际也在籽粒中不同程度表达,参与籽粒中RS和GABA的合成调控。
-
基于XJ-RILs群体的SNP遗传图谱[25],对筛选的候选基因进行变异位点分析。表6结果表明:qRS3-1、qRS4-1和qGABA7-1中有22个基因存在变异,均只有1个变异位点。qRS3-1中有7个基因存在SNP变异,5个存在Indel变异,其中有4个基因功能未得到注释,其余8个基因分别得到注释:Protein NLP (FtPinG0008950900.01)、SWEET sugar transporter (FtPinG0008951200.01)、Galactose-binding-like (FtPinG0008595500.01)、Homeobox (FtPinG0004083400.01)、Phosphoribosyltransferase C-terminal (FtPinG0001685300.01)、Protein kinase-like (FtPinG0008594800.01)、Protein DMP (FtPinG0008594400.01)和P-type ATPase (FtPinG0001685100.01)。
序号 基因 QTL 染色体 变异类型 变异位点信息
(‘小米荞’/‘晋荞麦2号’)基因注释 1 FtPinG0001690600.01 qRS3-1 Chr 3 SNP A/G 2 FtPinG0008950900.01 qRS3-1 Chr 3 SNP T/A NLP蛋白 3 FtPinG0008951200.01 qRS3-1 Chr 3 SNP T/A SWEET糖转运蛋白 4 FtPinG0008595500.01 qRS3-1 Chr 3 SNP A/T 半乳糖结合蛋白 5 FtPinG0004079200.01 qRS3-1 Chr 3 SNP G/A 6 FtPinG0004083400.01 qRS3-1 Chr 3 SNP A/G 同源框基因 7 FtPinG0001685300.01 qRS3-1 Chr 3 SNP G/A 磷酸核糖基转移酶 8 FtPinG0008594800.01 qRS3-1 Chr 3 Indel G/GT 蛋白激酶 9 FtPinG0008594400.01 qRS3-1 Chr 3 Indel CTTTTTA/C DMP蛋白 10 FtPinG0008127400.01 qRS3-1 Chr 3 Indel C/CA 11 FtPinG0008127200.01 qRS3-1 Chr 3 Indel A/AC 12 FtPinG0001685100.01 qRS3-1 Chr 3 Indel A/AATCAT P型ATP酶 13 FtPinG0001989400.01 qRS4-1 Chr 4 SNP G/A 14 FtPinG0001991700.01 qRS4-1 Chr 4 SNP T/C 核糖体蛋白L7Ae 15 FtPinG0006853900.01 qRS4-1 Chr 4 SNP G/A 硫氧还原蛋白类超家族 16 FtPinG0006854700.01 qRS4-1 Chr 4 Indel T/TG 细胞色素b5 17 FtPinG0009335600.01 qGABA7-1 Chr 7 Indel AT/A 亲环素类肽基脯氨酸顺反异构酶 18 FtPinG0008807100.01 qGABA7-1 Chr 7 Indel TC/T 泛醇-细胞色素c还原酶 19 FtPinG0008810800.01 qGABA7-1 Chr 7 Indel AATAT/A B-box型锌指结构 20 FtPinG0008811900.01 qGABA7-1 Chr 7 Indel G/GT 质体蓝素 21 FtPinG0006715500.01 qGABA7-1 Chr 7 Indel T/TATAATAATAATAATAATA 异戊二烯合成酶 22 FtPinG0005188800.01 qGABA7-1 Chr 7 Indel CTTGTTAAAGAAGTTTTG/C Table 6. Variant SNP/Indel sites of candidate genes
qRS4-1中有4个基因存在变异,3个基因存在SNP变异,1个基因存在Indel变异。这些基因中只有1个基因未得到注释,其余3个基因分别得到注释:Ribosomal protein L7Ae (FtPinG0001991700.01)、Thioredoxin-like superfamily (FtPinG0006853900.01)、Cytochrome b5-like heme (FtPinG0006854700.01)。
qGABA7-1中6个基因均为Indel变异,其中只有1个基因未得到注释,其余分别得到注释:Cyclophilin-type peptidyl-prolyl cis-trans isomerase (FtPinG0009335600.01)、Ubiquinol-Cytochromec Reductase (FtPinG0008807100.01)、B-box-type zinc finger (FtPinG0008810800.01)、Phytocyanin (FtPinG0008811900.01)和Isoprenoid synthase (FtPinG0006715500.01)。
-
本研究XJ-RILs群体中RS质量分数为4.51%~10.52%,低于周一鸣等[28]测得的RS范围(7.00%~35.00%),但也有研究表明苦荞中RS质量分数大于4.00%[29],与本研究所测结果相符合。郑发英等[30]研究表明不同提取方法得到的RS质量分数差异显著,因此推测可能是受到所用材料和RS提取方法的影响。不同品种的荞麦中,GABA的质量分数存在差异,本研究所测GABA质量分数为0.37‰~2.50‰,低于张余等[31]所测不同地方品种荞麦中GABA的质量分数(0.98‰~1.68‰);也低于朱丽伟等[32]所测多年生荞麦中GABA的质量分数(1.439‰~3.968‰);而邹亮等[33]所测的‘米荞1号’的GABA质量分数为0.048‰,低于本研究所测‘小米荞’(0.50‰),推测可能是GABA合成相关基因在不同品种荞麦中存在差异表达导致,RT-qPCR验证实验也证明了同一基因在不同品种的苦荞中存在差异表达,因而在不同品种的苦荞中GABA的质量分数存在较大差异。
聚类分析作为评价种质资源的重要手段,可以为资源的挖掘利用提供参考[34]。本研究通过聚类分析筛选到了苦荞XJ-RILs群体中RS优异的3个株系(R49、R160和R161),以及GABA优异的3个株系(R41、R48和R183),筛选到的株系可用于苦荞品种的遗传改良,也可作为高RS和GABA的选育材料。
本研究基于QTL定位预测到控制苦荞籽粒中RS和GABA的候选基因,在所定位筛选到的候选基因中,FtPinG008951200.01注释到SWEET家族基因,SWEET家族是一类糖转运蛋白,可以协助糖类顺浓度梯度运输[35]。本研究中该基因存在SNP变异,即A变异为T,在籽粒中高表达,推测该基因可以在苦荞籽粒发育的过程中协助蔗糖运输,为籽粒发育提供碳素营养。张计育等[36]的研究也表明SWEET家族内基因与籽粒中淀粉积累有关,LI等[37]研究了21个SWEET基因,其中有7个在籽粒发育的糖运输和从糖到淀粉的转化中起着重要作用。FtPinG0008807100.01注释到UQCR (ubiquinol-cytochromec reductase)家族内基因,UQCR是一种多亚基跨膜复合物,是线粒体电子传递链的一部分,参与ATP生成[38],而GABA的合成和代谢也与细胞内能量代谢相关,推测其可能参与GABA合成过程中能量代谢的调控。FtPinG0008811900.01注释到PC (phytocyanin),PC是一类铜电子转移蛋白,铜电子可作为GABA合成过程中的催化剂[39-40],RT-qPCR结果也显示FtPinG0008811900.01基因在籽粒中高表达,表明该基因调控了苦荞籽粒中GABA的合成。
-
本研究筛选到了RS高含量的株系(R49、R160和R161)以及GABA高含量的株系(R41、R48和R183)。在3号和4号染色体上定位到了2个RS的QTL位点,在7号染色体上定位到了1个GABA的QTL位点。对QTL区段内的候选基因进行检测,qRS3-1、qRS4-1和qGABA7-1分别检测到96、20和70个基因,从这些基因中初步筛选出30个调控RS的候选基因,21个调控GABA的候选基因,22个存在SNP/Indel变异的基因。本研究可为高RS和高GABA苦荞分子育种奠定基础,并为高RS和高GABA苦荞育种提供候选材料。
QTL mapping and candidate gene analysis of RS and GABA based on the recombinant inbred lines (RILs) of Fagopyrum tataricum
doi: 10.11833/j.issn.2095-0756.20240570
- Received Date: 2024-10-14
- Accepted Date: 2025-03-13
- Rev Recd Date: 2025-03-10
- Available Online: 2025-08-01
- Publish Date: 2025-08-01
-
Key words:
- Tartary buckwheat /
- quantitative trait locus /
- resistant starch /
- γ-aminobutyric acid /
- candidate gene
Abstract:
| Citation: | LIU Fei, HUANG Juan, DU Qianxi, et al. QTL mapping and candidate gene analysis of RS and GABA based on the recombinant inbred lines (RILs) of Fagopyrum tataricum[J]. Journal of Zhejiang A&F University, 2025, 42(4): 703−713 doi: 10.11833/j.issn.2095-0756.20240570 |









 DownLoad:
DownLoad: