-
高温是影响植物生长的重要环境因子,高温胁迫可以对植物的生长发育造成不可弥补的损害[1]。牡丹Paeonia suffruticosa属于芍药科Paeoniaceae芍药属Paeonia多年生落叶灌木。作为中国传统名花,牡丹不仅具有深厚的文化底蕴,还具有极高的观赏价值和经济价值。牡丹在长期栽培过程中形成了中原牡丹品种群、西北牡丹品种群、西南牡丹品种群和江南牡丹品种群[2]。江南牡丹品种群具有较强的耐热耐湿能力,但江南地区长期高温的气候会导致牡丹叶片发生卷曲萎蔫,致使江南牡丹品种群病虫害增多,观赏品质下降[2]。‘凤丹’P. suffruticosa ‘Feng Dan’为江南牡丹品种群的主要品种之一,具有突出耐热性,但其耐热机制仍不清楚。因此,选取‘凤丹’作为研究对象,解析其在高温胁迫下的响应机制,对于增强牡丹在江南地区的栽培适应性及拓展其景观应用具有重要的理论意义。
硫氧还蛋白(TRX)是介导细胞活性氧(ROS)控制的主要相关蛋白之一,由瑞典科学家在大肠埃希菌Escherichia coli体内首次发现并提取,具有保守的WC[G/P]PC基序。该基序参与靶蛋白的硫醇/二硫化物交换,可以还原目标底物以直接调节靶蛋白的活性[3−5]。TRX可以与抗氧化酶结合,以氧化还原依赖性方式,帮助维持细胞中的全局氧化还原环境,防止细胞内活性氧过量积累的氧化损伤并参与细胞内信号通路[6−7]。根据序列相似性、细胞内定位和分子功能,典型TRX家族被分为7种类型:f、m、h、o、x、y和z,位于叶绿体、线粒体和胞质溶胶等亚细胞区室中[8]。研究发现:TRX蛋白在非生物胁迫应答中起重要作用。AtTrxh3不仅具有氧化还原功能,还可以提高过表达拟南芥Arabidopsis thaliana 的耐热性[9]。大麦Hordeum vulgare Trxs基因可以使大麦抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)等抗氧化酶活性增强,缓解根系蛋白质和膜脂的氧化损伤,提高大麦对铝胁迫的抗性[10]。辣椒Capsicum annuum CaTRXh家族成员通过形成蛋白质复合物,在细胞中响应高温应激并发挥保护作用[6]。拟南芥中的TRX及其同源蛋白可通过控制体内各种光合作用相关蛋白的氧化还原状态来协调叶绿体功能[11]。核氧还蛋白最初在玉米Zea mays细胞核中被发现并命名,番茄Lycopersicon esculentum中的核氧还蛋白是热应激耐受性的正调节因子,它分别通过提高抗氧化能力和诱导HSP等热响应基因来保护细胞免受热应激诱导的氧化损伤和蛋白质变性[12−13]。尽管TRX基因在多种植物中参与非生物胁迫过程,但是TRX基因在牡丹耐热性中的功能尚未见报道。
因此,本研究以‘凤丹’高温胁迫转录组筛选获得的关键PsTRX1基因为研究对象,构建了PsTRX1转基因拟南芥株系,通过潮霉素筛选获得T3代纯合的阳性PsTRX1转基因拟南芥,通过表型观察、生理指标检测及抗氧化酶活性分析,系统探究PsTRX1在植物耐热性中的调控作用,为牡丹在江南高温高湿环境下的栽培应用提供理论依据。
-
本研究使用的牡丹品种‘凤丹’来自浙江农林大学暨阳学院实习实训基地。将试验组植株置于40 ℃高温条件下处理,培养环境设置为:相对湿度70%,光照强度8 000 lx,光周期14 h(光照)/10 h(黑暗)。分别于高温处理的0、6、12、24和48 h 进行取样,采集根、茎、叶、叶柄等部位,经液氮速冻后置于−80 ℃超低温冰箱中保存。
本研究使用的拟南芥为哥伦比亚野生型,用于过表达,烟草为本氏烟草Nicotiana benthamiana,用于亚细胞定位。过表达拟南芥和亚细胞定位载体为PHB-X-YFP,由浙江中医药大学周伟教授团队惠赠。大肠埃希菌DH5α、农杆菌Agrobacterium tumefaciens GV3101购自上海唯地生物公司。
-
使用美国国家生物技术信息中心(NCBI)数据库进行蛋白序列对比,获取相关同源序列后,通过MEGA 11.0软件将PsTRX1蛋白序列与得到的同源序列采用邻接法(neighbor-joinning)构建系统发育树,自展值(bootstrap)设置为1 000次,评估其进化关系。进一步利用DNAMAN 9.0软件进行多序列对比及同源性分析,同时利用NCBI-CD网站[NCBI Conserved Domain Search (https://www.ncbi.nlm.nih.gov/cdd/)]对蛋白的保守结构域进行功能分析与鉴定。
-
使用天根多糖多酚植物总RNA提取试剂盒(DP441)提取样本RNA,通过琼脂糖凝胶电泳(条件:400 mA,180 V,8 min)确认条带清晰、无降解后,使用Evo M-MLV Plus cDNA合成试剂盒(AG11707)将RNA反转录为cDNA。具体参考试剂说明书。
-
使用ClonExpress Ⅱ One Step Cloning Kit试剂盒(C112-02)将带有BamHI和BcuI酶切位点和部分PHB-X-YFP序列的PsTRX1基因片段与载体大片段按比例进行同源重组构建PHB-PsTRX1-YFP表达载体,反应条件为37 ℃ 30 min。将重组质粒转入农杆菌GV3101感受态细胞,保存于−80 ℃。
-
将PHB-PsTRX1-YFP融合表达载体和空载体质粒的农杆菌各取200 μL,接种至200 mL含有利福平(Rif)和卡那霉素(Kana)的LB液体培养液中,于28 ℃,200 r·min−1摇菌12~16 h;收集菌体沉淀,使用侵染液重悬至600 nm处吸光度为0.6,于28 ℃静置2 h;选取生长28 d,叶片嫩绿且完全展开的本氏烟草,将菌液注射进叶片进行瞬时表达,每个处理重复3片。将注射过的烟草黑暗处理24 h,置于正常光照环境下培养48 h后制片,使用激光共聚焦显微镜观察黄色荧光蛋白(YFP)荧光信号,分析PsTRX1蛋白的亚细胞定位。
-
使用Primer Premier 5.0设计特异性引物,以40 ℃高温处理0、6、12、24、48 h 的‘凤丹’根、茎、叶、叶柄部位的cDNA为模板,使用2×Q3 SYBR qPCR Master Mix试剂盒,以PsUbiqutin为内参基因,用2−ΔΔCt计算PsTRX1基因的相对表达量。聚合酶链式反应运行程序:50 ℃ 2 min;95 ℃ 2 min,95 ℃ 15 s,60 ℃ 15 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
-
利用花序侵染法转化拟南芥。试验前剪去拟南芥的种荚,每个花序浸泡30 s。侵染完植株侧倒放置,保鲜膜包裹,室温下黑暗处理24 h后正常培养,7 d后进行第2次侵染,步骤同上。待侵染的拟南芥植株种子成熟时,混合收种标记为T0,去除杂质置于适宜环境保存。
将T0种子消毒,播于含有20 mg·L−1潮霉素和30 g·L−1蔗糖的1/2 MS抗性培养基上,置于光周期16 h光照/8 h黑暗,23 ℃条件下培养7 d后,将生根并健壮生长的T1代幼苗移植到土壤中,期间提取转基因苗的DNA为模板,使用PHB-F/R引物(表1)进行阳性鉴定,得到目标条带的即为T1代阳性株系并标记。收取T1代阳性株系的种子,播于筛选培养基,种子正常生长得到的苗为T2代(分离比3∶1),分株收集T2代种子并标记。用同样的方式筛选至T3代即获得纯合转基因拟南芥株系。
引物 序列(5′→3′) 用途 Ubiqutin-F GACCTATACCAAGCCGAAG 内参 Ubiqutin-R CGTTCCAGCACCACAATC 内参 PsTRX1-dl-F ATCCATCACTGCAACCTCCG RT-qPCR PsTRX1-dl-R ACCTCCTCTACGACTACCGAT RT-qPCR PHB-PsTRX1-F CTCAAGCTTGGATCCATGGCCACTGTACTAGAATCCTTAGTT 克隆 PHB-PsTRX1-R GCCCTTGCTCACCATACTAGTCAAGAATTTCTCTATACAGGTGGTCAA 克隆 PHB-F GTGATATCTCCACTGACGTAAGGG 阳性鉴定 PHB-R ACCCTGAAGTTCATCTGCACCA 阳性鉴定 Table 1. Primer sequences
-
将PsTRX1转基因T3代拟南芥种子消毒,播于种子筛选培养基上,培养14 d后移栽至栽培基质中,置于人工气候箱培养至植株抽薹前,40 ℃高温处理2 d。处理前后分别拍照并取样,样品保存于−80 ℃超低温冰箱。
-
称取新鲜叶片0.02 g,剪细后放入10 mL试管中,加入10 mL V(无水乙醇)∶V(丙酮)为1∶1的混合液,室温下黑暗浸泡2~3 d,浸泡至叶片呈无色或白色,最后用无水乙醇定容至10 mL。取96孔板,吸取待测液加入,测定各处理组的叶绿素浸提液在波长663和645 nm处的吸光度[D(663)]和[D(645)],每个处理重复3次。计算公式如下:叶绿素a质量分数=[12.7D(663)−2.69D(645)]×[V/(1 000×m)];叶绿素b质量分数=[22.9D(645)−4.68D(663)]×[V/(1 000×m)];叶绿素总质量分数= 叶绿素a 质量分数+叶绿素b质量分数。其中:D(645)、D(663) 分别为波长645、663 nm下的吸光度;V为待测液的体积(mL);m为叶片鲜质量(g)或叶面积(cm2)。
-
过氧化氢(H2O2)、丙二醛(MDA)质量摩尔浓度,过氧化氢酶、过氧化物酶(POD)与超氧化物歧化酶(SOD)活性均采用苏州格锐思生物有限公司试剂盒进行测定。步骤参考说明书。
-
使用多功能植物效率分析仪M-PEA测定高温胁迫处理0和2 d的野生型和转基因株系的即时荧光(PF)、延迟荧光(DF)和调制反射(MR)动力学曲线,测定前对叶片进行20~30 min黑暗处理,每组转基因株系选取3片大小相近的叶片作为重复,使用叶绿素荧光动力学曲线(JIP-test)分析相关的叶绿素荧光参数。曲线中最小荧光(Fo)至最大荧光(Fm)的积分面积的物理含义是关闭植物所有反应中心所需能量的量度,反映了使还原侧电子受体(QA)完全被还原,即变成初级电子受体(QA−)所需要的能量。电子从QA−进入电子传递链越多,则到达Fm所需要的时间就越长,Fo至Fm的积分面积也越大。反之,当植物受到损伤时,Fo至Fm的积分面积也越小。
-
使用SPSS 25.0对数据进行单因素方差分析及方差检验,并借助GraphPad Prism 9.0进行数据整理与绘图。
-
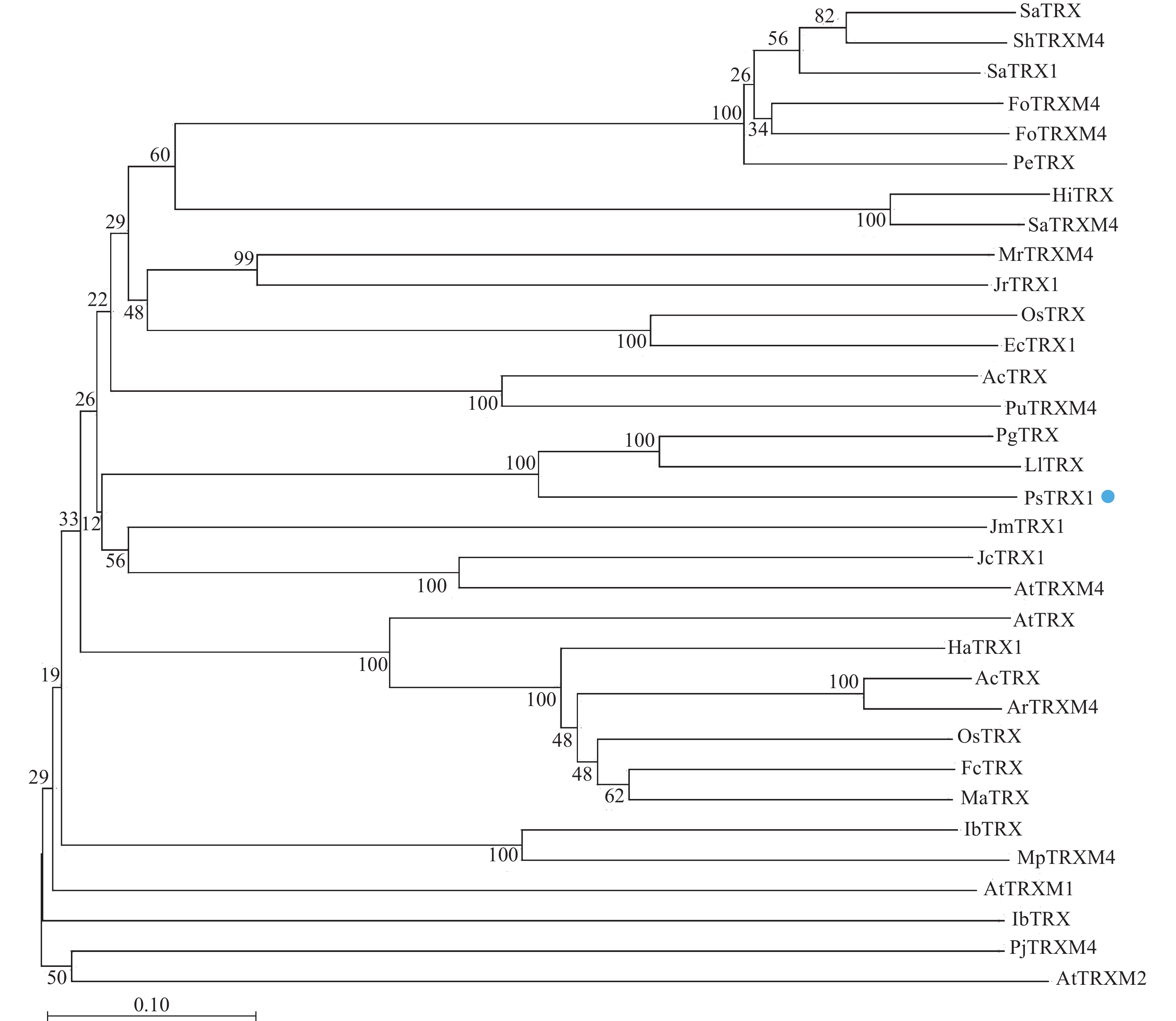
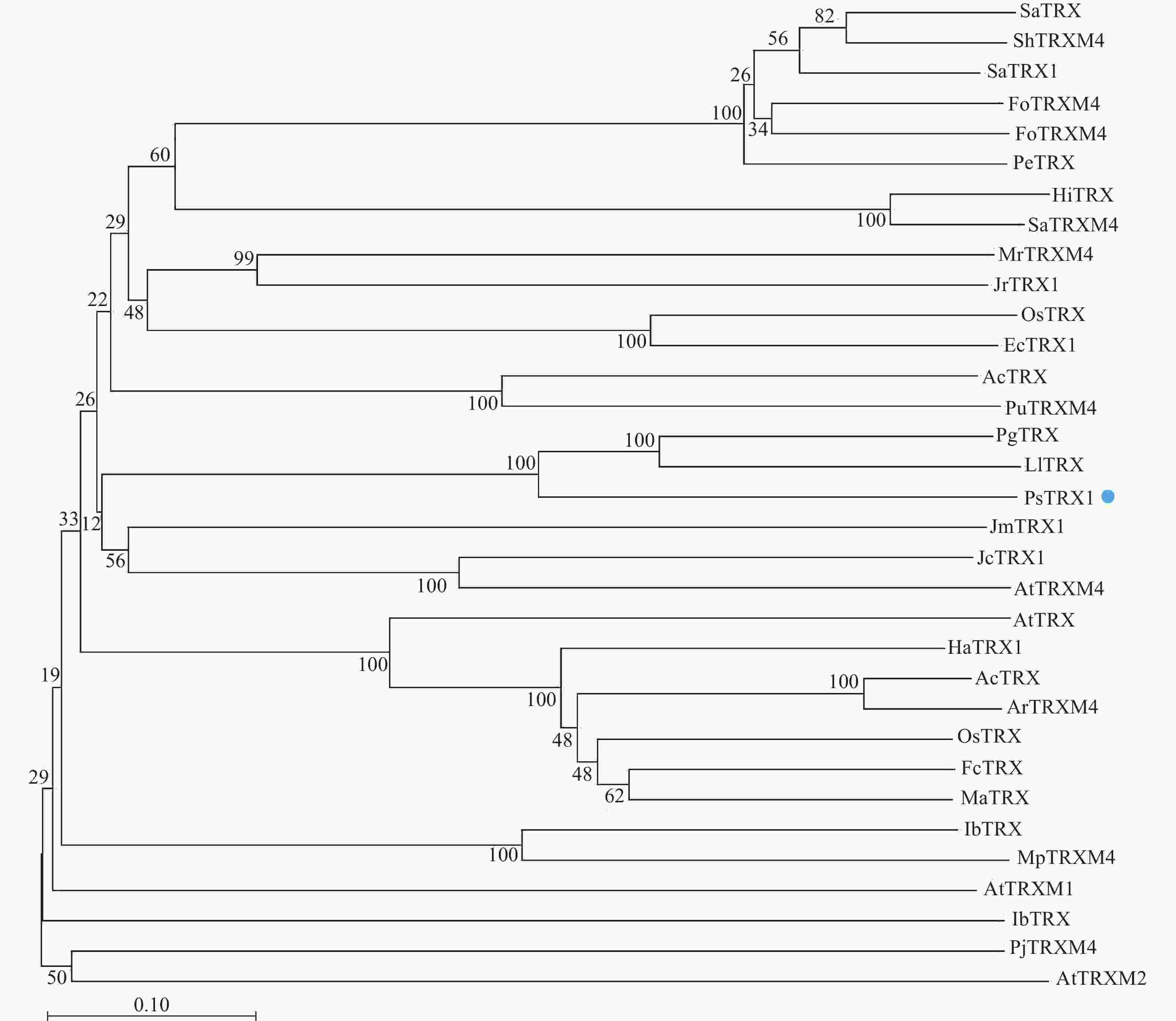
通过Blast分析比对PsTRX1蛋白序列的同源序列,将比对的蛋白采用邻接法构建系统进化树,自展值设定为1 000。结果显示:PsTRX1蛋白与木姜叶柯Lithocarpus litseifolius和番石榴Psidium guajava的TRX1蛋白亲缘关系最近,同源性最高(图1)。
为进一步分析其保守结构域,利用DNAMAN 9.0将该基因的蛋白序列与木姜叶柯、番石榴、皂皮树Quillaja saponaria、翅芝麻Sesamum alatum、中华猕猴桃Actinidia chinensis、杨梅Morella rubra、向日葵Helianthus annuus、紫花风铃木Handroanthus impetiginosus及大花五桠果Dillenia turbinata的TRX蛋白序列进行多序列对比,并根据NCBI网站的CD-Search分析其保守结构域和保守基序。结果显示:PsTRX1蛋白序列含有1个特征性的WCGPC基序和1个典型的硫氧还蛋白结构域(图2)。
-
从牡丹基因组中获得牡丹PsTRX1基因转录起始位点上游的2 000 bp基因序列,并作为其启动子序列。在PlantCARE在线工具中分析了PsTRX1基因启动子的顺式元件。由表2可知:PsTRX1基因的启动子富含胁迫相关元件。
顺式作用元件名称 序列 功能 数量 ABRE ACGTG 脱落酸响应元件 1 AAGAA-motif GAAAGAA 脱落酸响应元件 1 circadian CAAAGATATC 昼夜节律调节元件 1 ERE ATTTTAAA 乙烯响应元件 2 MYC CATTTG 转录因子MYC响应元件、干旱响应元件 2 CAAT-box CAAT/CAAAT/CCAAT 启动子和增强子区域中常见的顺式作用元件 32 G-box CACGTT 光响应元件 1 CGTCA-motif CGTCA 茉莉酸甲酯响应元件 1 MYB CAACCA 参与干旱和ABA应答的元件 3 AE-box AGAAACAA 光响应元件 1 Box4 ATTAAT 光响应元件光应答的保守DNA组成部分 1 AT-rich element ATAGAAATCAA 富含AT的DNA结合蛋白结合位点 2 GATA-motif GATAGGG/AAGATAAGG 光响应元件 2 I-box AAGATAAGGCT/CCTTATCCT 光响应元件 2 TCA-element CCATCTTTTT 水杨酸响应元件 1 P-box CCTTTTG 赤霉素响应元件 1 TCT-motif TCTTAC 光响应元件 1 TCCC-motif TCTCCCT 光响应元件 1 TATA-box TATAAA/TATA/TATAA/TATAAGAA/TATACA/
ATATAA/ATATAT/TACAAAA转录开始-30左右的核心启动子元素 16 MRE AACCTAA 参与光响应的MYB结合位点 1 RY-element CATGCATG 种子特异性调控元件 1 3-AF1 binding site TAAGAGAGGAA 光响应元件 1 TGACG-motif TGACG 茉莉酸甲酯响应元件 1 Table 2. Analysis of cis-acting elements in the promoter region of the PsTRX1 gene of peony
-
将PHB-TRX1-YFP融合载体和空载体质粒分别转化至农杆菌,并注射进烟草叶片中进行瞬时表达。利用激光共聚焦显微镜对荧光信号进行观察。结果显示:空载体质粒转化的烟草叶片,YFP荧光均匀分布在细胞核和细胞质中,而转PHB-TRX1-YFP融合载体的烟草叶片中,YFP荧光信号可与叶绿体自发荧光完全共定位,表明PsTRX1蛋白特异性地定位于叶绿体(图3)。
-
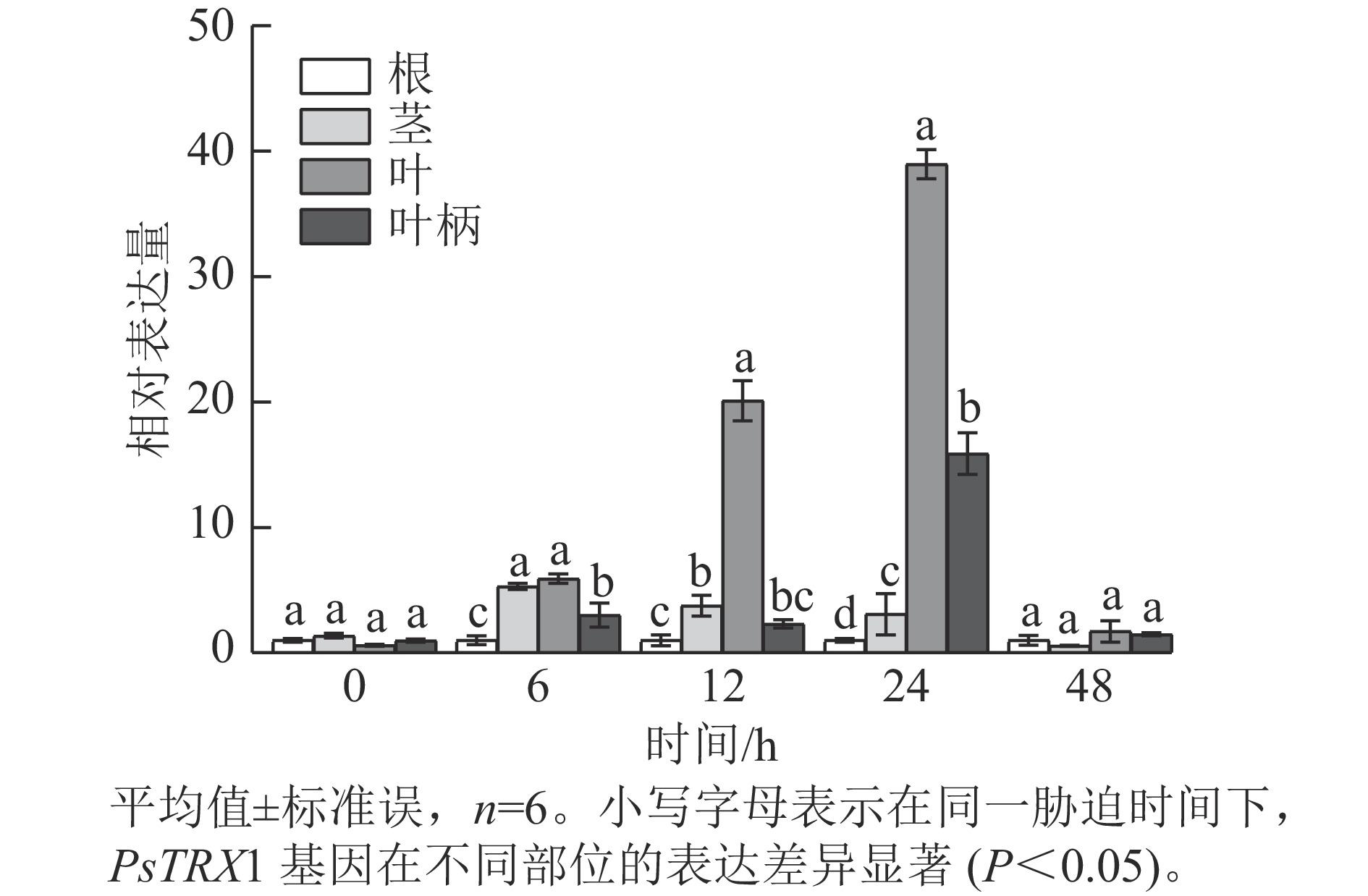
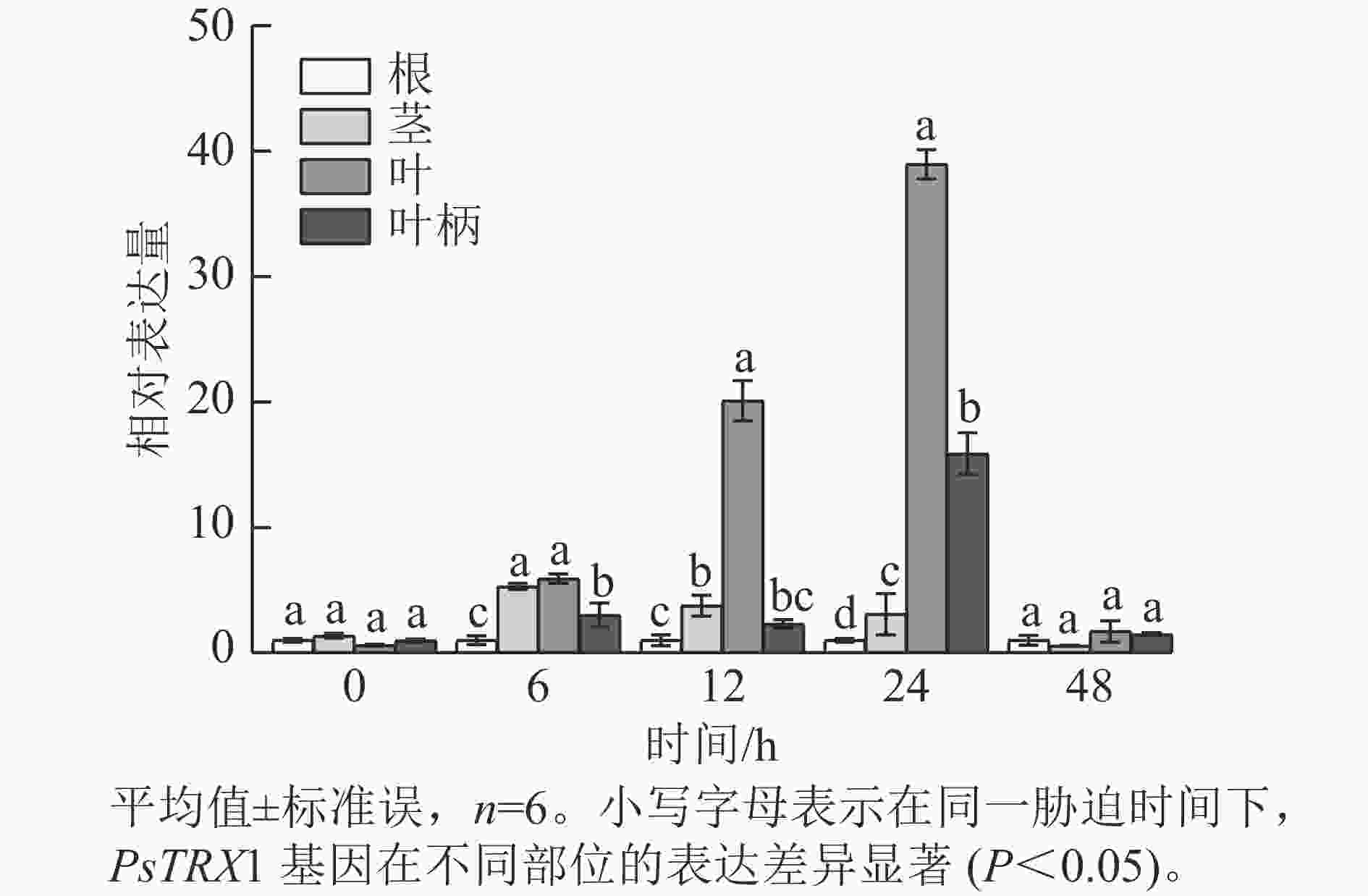
表达模式分析发现:高温胁迫前,PsTRX1基因在各组织中的表达量没有显著差异,高温胁迫6 h后,PsTRX1基因在茎、叶和叶柄中的表达量显著升高(P<0.05),随着热处理时间增加在叶片中的表达量显著升高(P<0.05),24 h达到峰值,之后便呈现下降趋势(图4)。表明PsTRX1基因可受热处理诱导,该基因可能在牡丹耐热过程中发挥一定的作用。
-
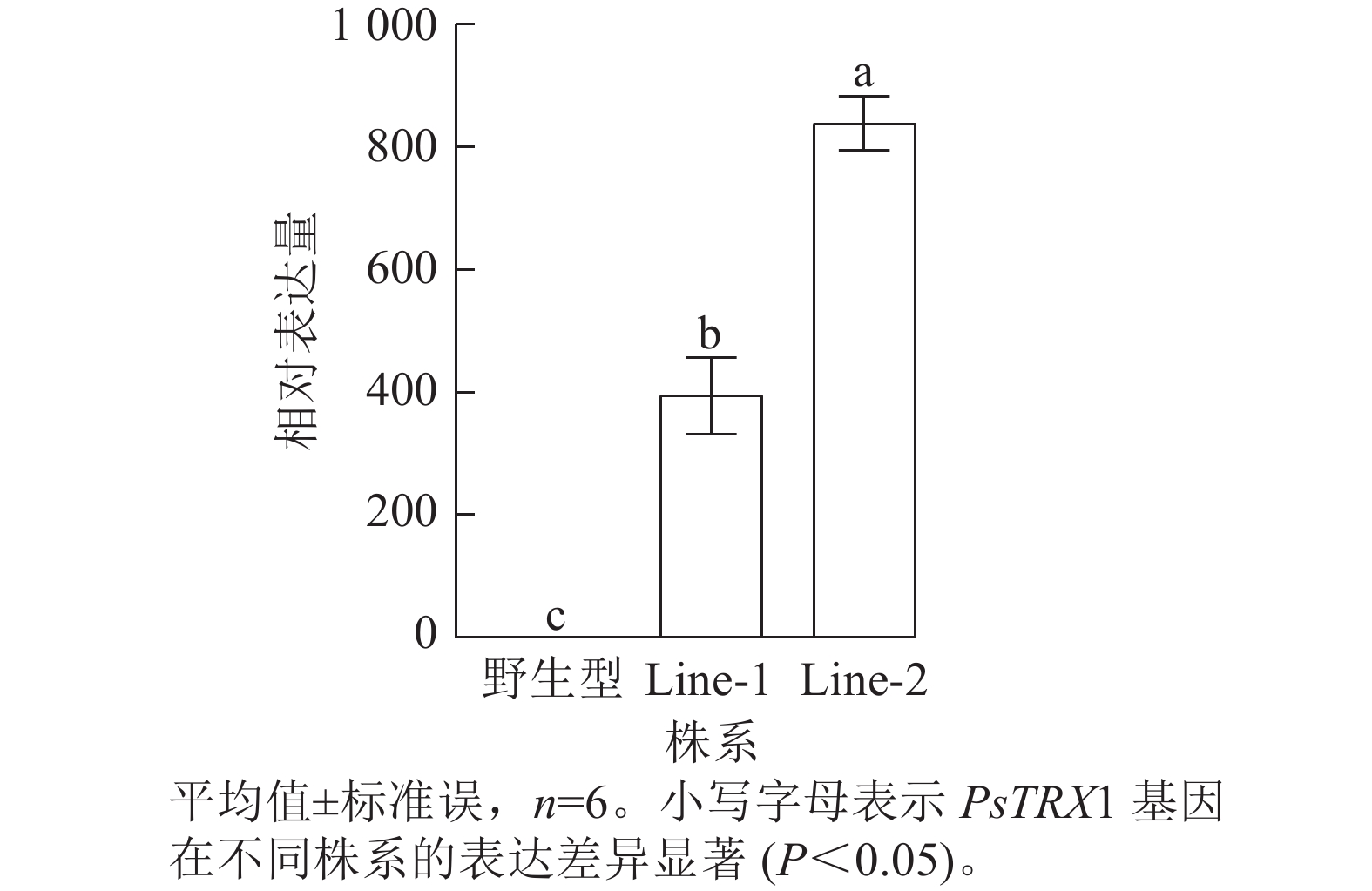
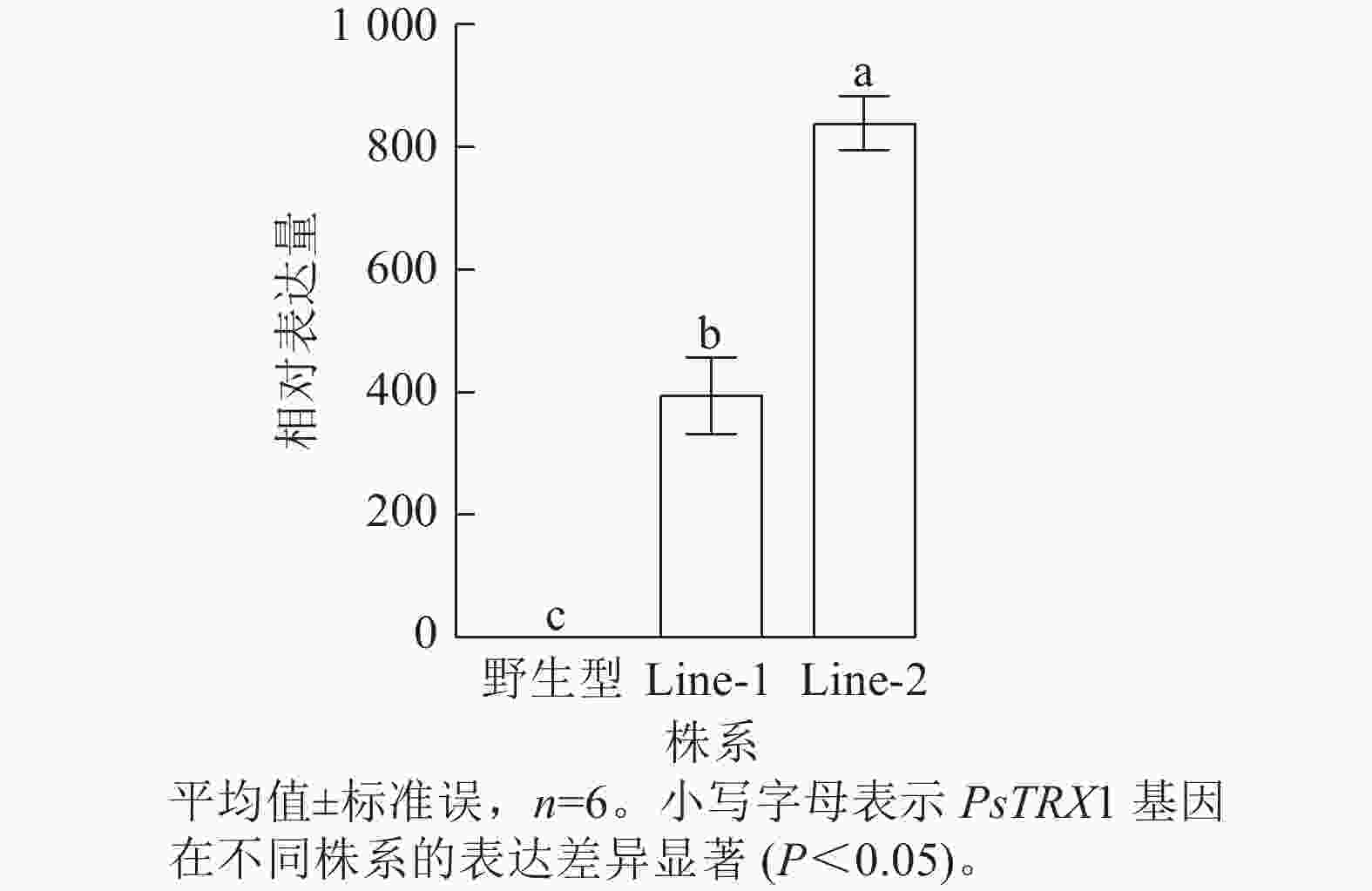
利用潮霉素筛选阳性转基因拟南芥株系,使用PHB-F/R引物(表1)进行阳性鉴定,获得PsTRX1转基因阳性株系4株。将转基因拟南芥筛选至T3代播种培养,选取其中2株转基因拟南芥阳性株系(Line-1和Line-2)进行试验,对野生型、过表达拟南芥株系Line-1和Line-2的PsTRX1基因的相对表达量进行RT-qPCR分析。过表达拟南芥株系中PsTRX1的相对表达量显著高于野生型株系(P<0.05)(图5)。
-
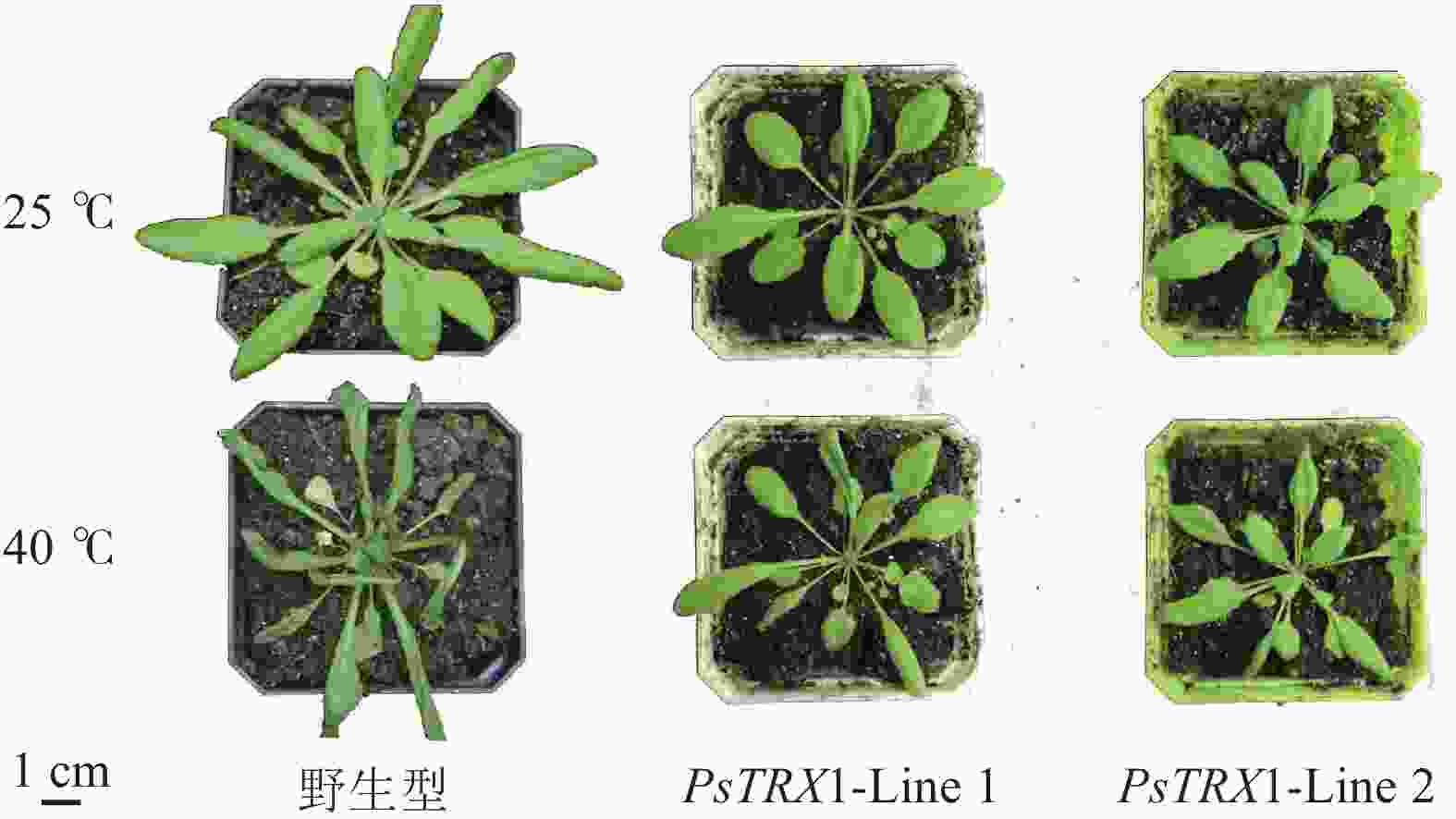
对苗龄28 d的野生型及PsTRX1转基因拟南芥植株分别在40 ℃下处理2 d,观察到叶片表型存在差异。高温胁迫后,野生型叶片发黄皱缩较为明显,相比之下,转基因拟南芥生长状态更为良好,叶片颜色变化较小,叶片形状保持相对完整,表明PsTRX1正向调控拟南芥植株对高温胁迫的耐受性(图6)。
-
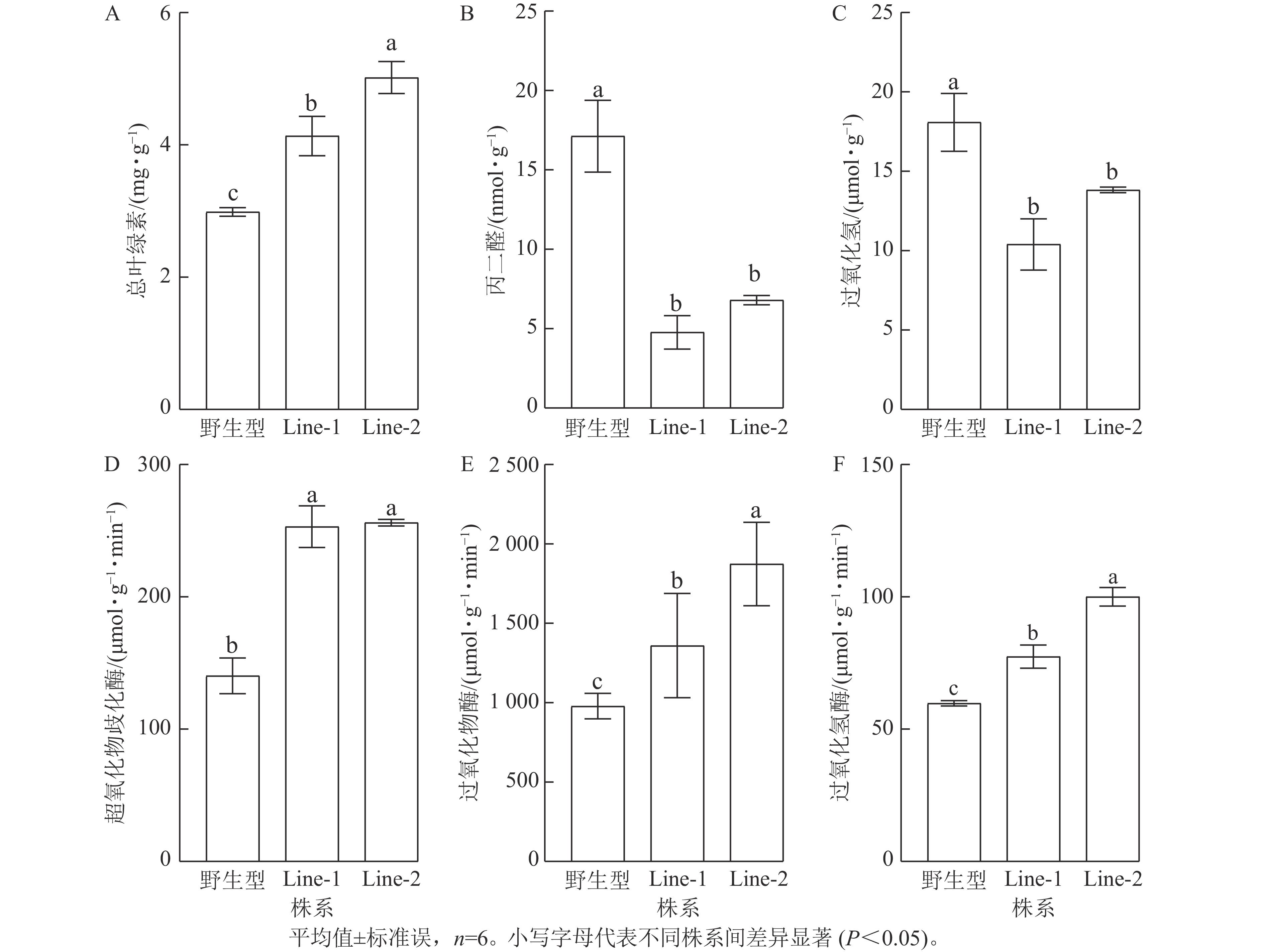
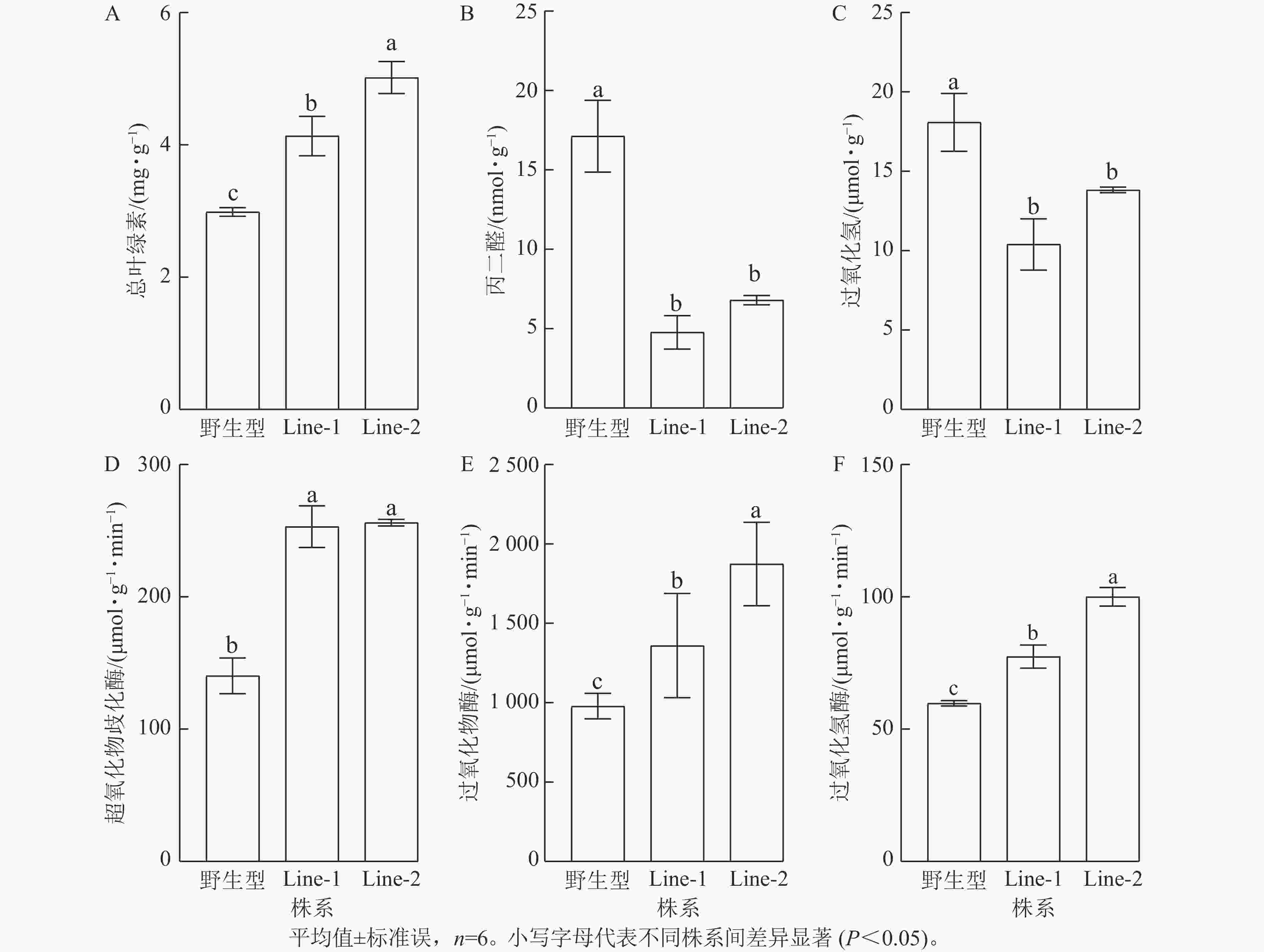
高温胁迫影响植物光合作用,导致叶绿素等色素产量减少,因此叶绿素质量分数的变化可以反映植物的胁迫程度[14]。结果显示:高温胁迫2 d后的PsTRX1转基因拟南芥总叶绿素质量分数显著高于野生型(P<0.05),表明野生型受高温胁迫的程度较高(图7A)。高温胁迫后转基因拟南芥的过氧化氢与丙二醛质量摩尔浓度均显著低于野生型(P<0.05),表明高温胁迫后野生型产生了更多的活性氧,质膜氧化程度更高(图7B、C)。植物依赖抗氧化酶系统产生抗氧化酶来清除活性氧,高温胁迫后转基因拟南芥的抗氧化酶超氧化物歧化酶、过氧化物酶、过氧化氢酶活性均显著高于野生型(P<0.05)(图7D、E、F)。以上结果表明高温处理后,野生型相较于转PsTRX1基因拟南芥受胁迫程度更高。
-
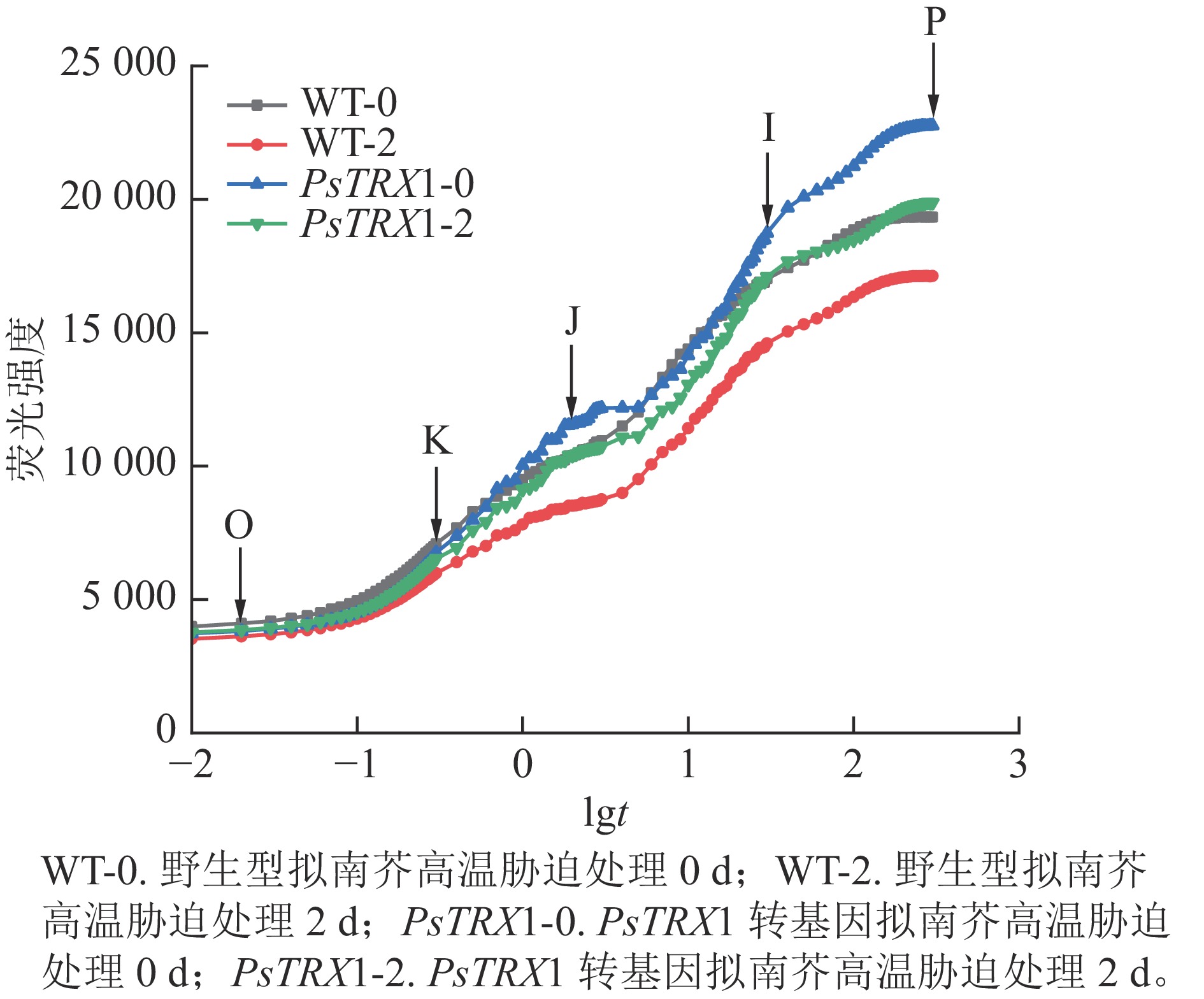
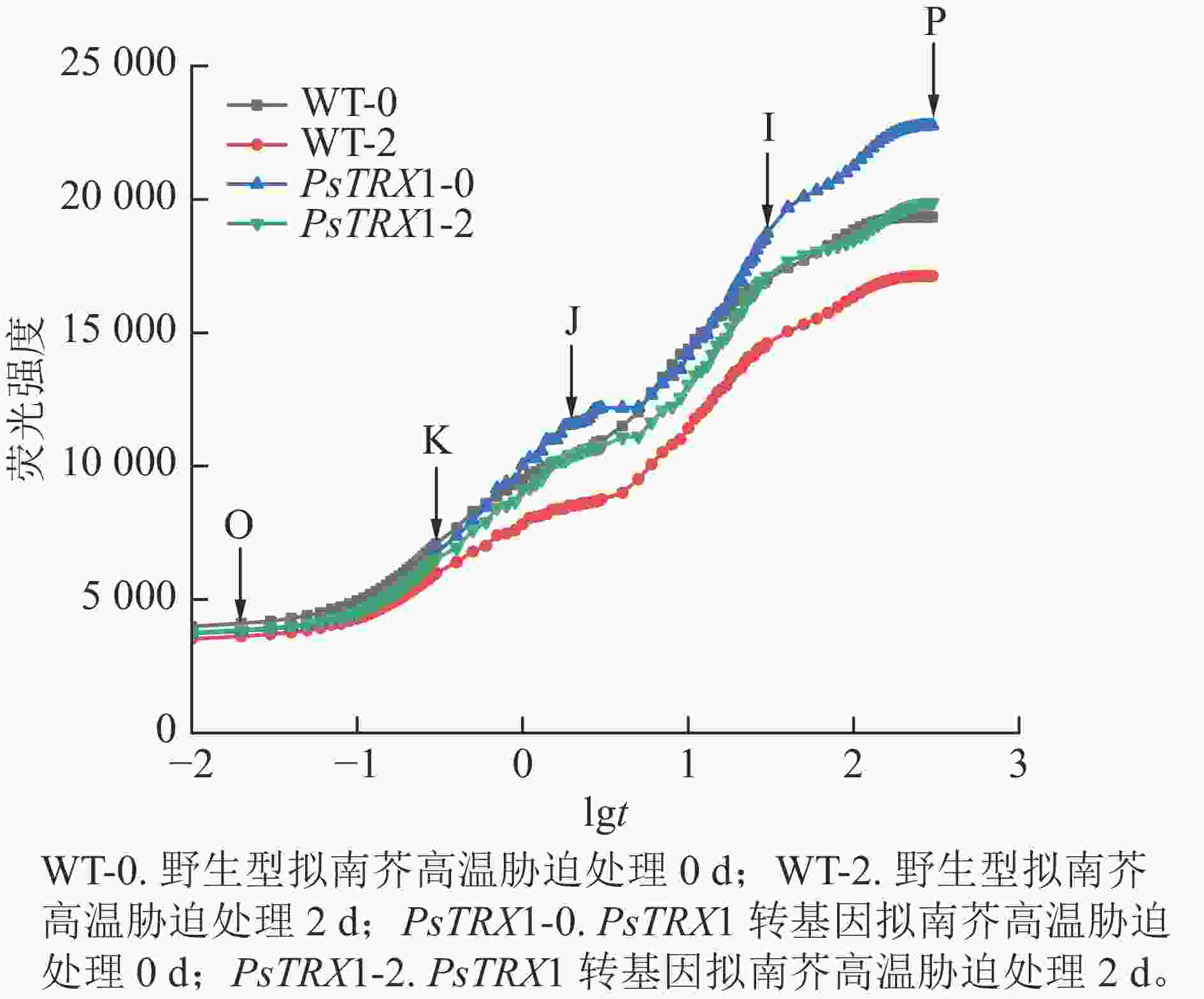
高温胁迫会显著影响叶绿素的荧光响应特征。高温下转基因拟南芥的快速荧光动力学曲线如图8所示:常温下(25 ℃)的野生型和转基因拟南芥的OJIP曲线显示为典型的O-J-I-P形状,同时在300 µs左右出现了新的中间步骤“K”点。此时“K”点并不明显;高温处理后,野生型和转基因拟南芥的OJIP曲线上的“K”点明显,曲线由O-J-I-P形状变为O-K-J-I-P曲线。随着“K”点的出现,热胁迫下叶片的叶绿素荧光强度和P值也急剧下降。曲线中Fo至Fm的积分面积的物理含义是关闭植物所有反应中心所需能量的量度,反映了使QA完全被还原(变成QA−)所需要的能量。电子从QA−进入电子传递链越多,则到达 Fm所需要的时间就越长,Fo至Fm的积分面积也越大。反之,当植物受到损伤时,Fo至Fm的积分面积也越小。高温下野生型株系的荧光值面积大幅下降,转基因拟南芥的荧光值面积下降幅度较小。综上所述,野生型株系在高温胁迫下受到的损伤更重,PsTRX1可能通过维持叶绿体氧化还原稳态,从而提高耐热性。
-
活性氧是细胞正常代谢的产物,通常以极低的含量存在于植物体内,但在高温胁迫下植物体内的活性氧会迅速积累[15−16]。活性氧的积累会触发植物抗氧化系统的激活,其中TRX是调控氧化还原稳态的核心组分。TRX主要在叶绿体的氧化还原系统中发挥作用,是干旱胁迫期间抗氧化反应所必需的[17−18]。在氧化还原系统内,光驱动电子传递链中由光能驱动水裂解产生的还原力通过铁氧还蛋白和铁氧还肽Trx还原酶转移到硫氧还蛋白[19]。本研究从‘凤丹’中克隆出了1个PsTRX1基因片段,基因序列长度为564 bp,氨基酸为188个。经序列分析发现:牡丹PsTRX1蛋白具有特征性的WCGPC保守基序作为活性中心。植物中的TRX蛋白最初是在叶绿体中发现的,TRXf、TRXm、TRXx、TRXy主要定位于叶绿体中[20]。本研究亚细胞定位结果显示:PsTRX1定位在叶绿体中。推测PsTRX1基因可能在叶绿体氧化还原系统中发挥作用,从而调节植物高温胁迫过程。
硫氧还蛋白调控植物的多个生物过程,同时在植物应对各种逆境胁迫时起重要作用。大麦中有15个典型TRX基因家族成员被鉴定,预测其启动子并结合大麦干旱胁迫下的转录组分析发现:该基因家族成员参与大麦干旱胁迫[21]。粟Setaria italica中的NRX亚型TRX基因SiNRX1增强了拟南芥对干旱和盐胁迫的耐受性[22]。杂交鹅掌楸Liriodendron hybrid中的LhTRX-h3基因在响应非生物胁迫时显著上调,可以提高杂交鹅掌楸的抗旱性[23]。研究基因启动子的顺式作用元件可以了解基因的潜在功能。对PsTRX1基因的启动子顺式作用元件分析发现:PsTRX1基因启动子包含多个与胁迫相关的顺式作用元件,推测其参与非生物胁迫。RT-qPCR结果显示:PsTRX1基因在高温处理后表达量升高,可能参与牡丹高温胁迫过程。
高温会增加植物细胞膜的通透性,导致膜蛋白变性和质膜分离,丙二醛质量摩尔浓度升高,同时活性氧增加,对植物造成氧化胁迫。PsTRX1转基因拟南芥株系的表型分析结果和生理指标分析结果均显示:野生型植株受高温胁迫的程度更高。近年来的研究对叶绿体氧化还原系统有了新的认识,揭示了TRX蛋白的功能多样性[24−25]。氧化还原系统能够可逆地调控靶蛋白的氧化还原状态,TRX蛋白在这一过程中发挥核心作用,可以调控酶活性以应对各种胁迫。同时,TRX蛋白参与光系统Ⅰ(PSⅠ)的氧气(O2)还原,从而调节活性氧的积累[26]。因此推测PsTRX1基因可能通过抗氧化酶系统来清除活性氧[27−28]。同时,快速叶绿素荧光诱导动力学曲线结果也说明:野生型植株受胁迫程度更高。高温胁迫会抑制光系统Ⅱ(PSⅡ)的功能活性,因此高温胁迫与叶绿素紧密相关[29]。本研究采用快速叶绿素荧光诱导动力学分析,评价高温胁迫对转PsTRX1基因拟南芥叶片光系统Ⅱ光化学效率的影响。JIP测试可以用于评估不同的胁迫类型,还可以区分对特定胁迫类型的特定响应,例如,可以区分基因型差异、胁迫强度差异或胁迫植物发育阶段差异的响应[30]。快速叶绿素荧光诱导动力学曲线是指从O点到P点的荧光变化过程,主要反映了光系统Ⅱ的电子传递池的连续还原过程[31]。典型的快速叶绿素荧光动力学曲线包括荧光上升阶段的O、J、I和P相。相位O-J高度依赖于光,该部分荧光升高与一些光系统Ⅱ反应中心的关闭有关。J-I部分对应于次级电子受体(QB)、质体醌(PQ)、细胞色素(Cyt b6f)和质蓝素(PC)的还原。I-P部分与光系统Ⅰ受体侧电子转运蛋白的减少有关或与由820 nm透射测量确定的线性电子传输的可用性有关[32−34]。本研究中OJIP荧光强度在高温处理后下降,Fo、可变荧光(Fv)和Fm显著降低,表明胁迫会降低荧光强度。同时,拟南芥受到高温胁迫时,会出现K波段(300 μs),这是因为高温会抑制放氧复合体(OEC),并阻断放氧复合体与酪氨酸之间的电子传递,在很短的时间内,叶绿素荧光强度迅速增加。换句话说,作为光系统Ⅱ供体光抑制的特定指标,导致O-J-I-P曲线转变为O-K-J-I-P曲线[33−35]。Fo和Fm之间的荧光诱导曲线的面积与光系统Ⅱ还原侧电子受体(QA)的池大小呈正比。如果电子从反应中心到醌池的转移被阻断,这一区域将大大减少。本研究高温下各拟南芥的荧光值面积不同,与野生型植株相比,转PsTRX1基因拟南芥的荧光值面积没有显著降低,受高温胁迫的程度更低,表明PsTRX1基因可赋予植物耐热性,与得到的表型结果和生理指标结果一致。
-
牡丹PsTRX1属于硫氧还蛋白家族,定位于叶绿体。牡丹PsTRX1基因受热胁迫诱导。高温胁迫后,PsTRX1基因在茎、叶和叶柄中快速响应热胁迫并在叶片中的表达量持续升高,于24 h时达到峰值,之后便呈现下降趋势。在高温胁迫下,过表达PsTRX1基因的拟南芥比野生型植株生长状态更好,叶片皱缩程度更轻,叶绿素质量分数更高,丙二醛和过氧化氢质量摩尔浓度更低,抗氧化酶活性更高,叶绿素荧光值面积下降幅度较小。以上结果均证明牡丹PsTRX1基因正向调控拟南芥的耐热性。
Expression characteristics and functional analysis of PsTRX1 gene inPaeonia suffruticosa in response to high temperature stress
doi: 10.11833/j.issn.2095-0756.20250457
- Received Date: 2025-08-25
- Accepted Date: 2025-10-06
- Rev Recd Date: 2025-10-05
- Available Online: 2025-10-15
- Publish Date: 2025-10-20
-
Key words:
- Paeonia suffruticosa /
- high temperature stress /
- PsTRX1 gene /
- expression pattern analysis /
- overexpression
Abstract:
| Citation: | QI Peiyun, XIE Yuxuan, XU Caini, et al. Expression characteristics and functional analysis of PsTRX1 gene inPaeonia suffruticosa in response to high temperature stress[J]. Journal of Zhejiang A&F University, 2025, 42(5): 1014−1024 doi: 10.11833/j.issn.2095-0756.20250457 |











 DownLoad:
DownLoad: