-
白芷药材为伞形科Apiaceae植物白芷Angelica dahurica或杭白芷A. dahurica var. formosana的干燥根,具有解表散寒、祛风止痛、宣通鼻窍、燥湿止带、消肿排脓的功效[1]。白芷含有香豆素类、挥发油类、苷类、生物碱类、多糖类、氨基酸类等多种化学成分[2],香豆素是白芷中含量较多的一大类活性成分。已有研究表明[3−5]:水合氧化前胡素、白当归素、佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素、花椒毒酚等主要标志性成分可以反映白芷药材的质量差异。在遗传方面,刘倩倩等[6]和侯凯等[7]分别应用分子标记对不同白芷资源遗传组成开展研究,结果显示SSR和ISSR标记均可以应用于白芷资源的遗传组成研究。然而已有研究的取样范围较窄,大多未包括传统的北方白芷产区。同时,白芷资源存在产地变迁和引种栽培行为,但近10 a对白芷的研究集中在品质成分、栽培技术和药理等方面,而有关白芷遗传的研究却较少。相关序列扩增多态性(SRAP)是基于PCR技术的经典标记系统[8],多应用于药用植物群体遗传组成分析[9−10]。
遗传组成和产地环境的差异均有可能引起白芷药材品质和化学组成变异,已有研究多是通过采集不同产地材料分析不同产区的白芷药材品质差异[4, 11],没有系统地分析不同白芷主产区样品的遗传组成及其与品质变异的相关性。本研究收集中国白芷主产区种源,栽培于同一个资源圃内,应用SRAP分子标记对收集的白芷样品进行遗传组成分析,从遗传背景上对不同种源进行区分,同时,通过测定7种香豆素化学成分对白芷进行品质评价,探究不同产地间白芷遗传组成与品质差异的相关性,为白芷药材开发及新品种选育提供理论依据。
-
2019年10月,在四川、浙江、安徽、河北、河南等白芷主产区省份收集25份白芷资源(表1),栽培于杭州市原种场。2020年9月,在叶片枯萎时对同圃种植的25份白芷资源进行采收,取白芷根部,55 ℃烘干后打粉,编号后置于4 ℃冰箱密封保存。
表 1 供试白芷种源信息
Table 1. Information of tested materials of A. dahurica
编号 来源 种质类型 基原 纬度(N) 经度(E) 海拔/m HBQ-1 河北省保定市安国市祁州镇-1 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 33 HBQ-2 河北省保定市安国市祁州镇-2 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 32 HBQ-3 河北省保定市安国市祁州镇-3 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 33 HBQ-4 河北省保定市安国市祁州镇-4 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 32 HBY-1 河北省保定市安国市易州镇-1 本地栽培 白芷 39°20′43.56″ 115°30′06.04″ 50 HBY-2 河北省保定市安国市易州镇-2 本地栽培 白芷 39°20′43.56″ 115°30′06.04″ 45 HBD-1 河北省保定市安国市大五女镇-1 本地栽培 白芷 38°22′16.83″ 115°12′54.73″ 37 HBD-2 河北省保定市安国市大五女镇-2 本地栽培 白芷 38°22′16.83″ 115°12′54.73″ 36 HB-B 河北省保定市安国市北段村乡 本地栽培 白芷 38°28′13.34″ 115°17′48.67″ 30 HN-G 河南省许昌市禹州市古城镇 本地栽培 白芷 34°13′37.53″ 113°33′44.31″ 169 JS-X 江苏省宿迁市沭阳县新河镇 引种栽培 白芷 34°10′55.57″ 118°39′35.60″ 16 SD-X 山东省烟台市莱阳市穴坊镇 引种栽培 白芷 36°40′02.15″ 120°43′52.90″ 37 HN-L 湖南省邵阳市邵东县廉桥镇 引种栽培 白芷 27°19′25.00″ 111°50′56.70″ 208 ZJ-F 浙江省杭州市淳安县枫树岭镇 本地栽培 杭白芷 29°22′04.26″ 118°42′34.62″ 370 ZJ-Y 浙江省金华市磐安县新渥镇(仰头村) 本地栽培 杭白芷 28°58′28.49″ 120°25′47.97″ 560 ZJ-M 浙江省金华市磐安县新渥镇(麻车下村岩岗) 本地栽培 杭白芷 28°59′27.89″ 120°23′13.20″ 570 ZJ-L 浙江省金华市磐安县冷水镇 本地栽培 杭白芷 28°53′59.36″ 120°20′59.61″ 303 ZJ-B 浙江省台州市仙居县白塔镇 本地栽培 杭白芷 28°44′59.86″ 120°36′04.52″ 78 SC-Q 四川省遂宁市蓬溪县群利镇 本地栽培 杭白芷 30°22′59.82″ 105°58′30.98″ 338 SC-B 四川省遂宁市蓬溪县宝梵镇 本地栽培 杭白芷 30°40′58.73″ 105°41′06.79″ 408 SC-Y 四川省遂宁市船山区永兴镇 本地栽培 杭白芷 30°33′51.02″ 105°36′27.35″ 293 CQ-T 重庆市大足区铁山镇 本地栽培 杭白芷 29°41′10.54″ 105°34′01.12″ 417 AH-S 安徽省亳州市谯城区十九里镇 引种栽培 杭白芷 33°48′38.23″ 115°47′15.30″ 39 AH-H 安徽省亳州市谯城区华佗镇 引种栽培 杭白芷 33°56′03.63″ 115°46′48.82″ 39 AH-Q 安徽省亳州市谯城区谯东镇 引种栽培 杭白芷 33°50′53.42″ 115°52′33.24″ 37 -
实验仪器主要包括Agilent 1260高效液相色谱仪(Agilent公司,美国)、色谱柱(Agilent Eclipse XDB-C18 4.6 mm×250 mm)、Veriti 96 Well Thermal Cycler型PCR仪(Thermo Fisher Scientific公司,美国)、Power PacTM-Basic/HV型电泳仪、GelDocTM XR +型凝胶成像仪(美国Bio-Rad公司)。欧前胡素(批号:HS19326S1)、异欧前胡素(批号:HS9499S1)、白当归素(批号:HR19108W3)、氧化前胡素(批号:HR71244W5)、佛手柑内酯(批号:HR1141W8)、水合氧化前胡素(批号:HS91011B1)对照品均购自于宝鸡市辰光生物科技有限公司;花椒毒酚对照品(批号:nkl211109006)购自于成都钠钶锂生物科技有限公司;甲醇(批号:20210322)、乙醇(批号:20200710)为分析纯,购自于上海凌峰化学试剂有限公司;流动相甲醇为色谱纯(批号:U9OG1H),水为重蒸馏去离子水。三羟基甲基氨基甲烷(批号:T57320)、核酸染料YeaRed、2×HieffTM PCR Master Mix等均购自于上海翊圣生物科技有限公司;SRAP引物委托上海生工生物公司合成,置4 ℃冰箱保存。所有试剂均为分析纯。
-
取供试样品粉末2 g,置于100 mL锥形瓶中,加入50 mL水,密塞,称质量,静置1 h后,连接回流冷凝管,加热至沸腾,并保持微沸1 h。放冷后,取下锥形瓶,密塞,再称质量,用水补足减失的质量,摇匀,用干燥滤器滤过,量取滤液10 mL,置于已干燥至恒量的蒸发皿中,在水浴锅上蒸干,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速称质量。以供试样品的干燥品计算供试样品中的醇溶性浸出物质量分数(%),每个供试样品重复3次。
-
色谱柱为Agilent Eclipse XDB-C18 (4.6 mm×250 mm,5 µm);流动相为甲醇(B)-水(A),梯度洗脱百分值为体积分数,洗脱程序为:0~25 min,40%~45%B;25~45 min,45%~60%B;45~50 min,60%~80%B;50~60 min,80%B;60~70 min,80%~90%B;70~75 min,90%~40%B;75~80 min,40%B;流速为1.0 mL·min−1;柱温为25 ℃;进样量为10 µL;检测波长设定为300 nm。
-
称取水合氧化前胡素、白当归素、佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素、花椒毒酚适量,加甲醇溶解,转移至10 mL容量瓶,将其配置成1 mL分别含有0.728、0.659、0.699、0.639、0.721、0.747、0.639 mg标准品的单一对照样品溶液;吸取上述储备液适量,混合后加甲醇稀释,使最终制成质量浓度分别为12.760、4.482、5.768、35.649、37.856、14.498、6.390 mg·L−1的混合对照样品溶液。
-
取供试样品粉末(过3号筛) 1.0 g,置于50 mL量瓶中,加45 mL甲醇,超声处理(功率300 W,频率50 kHz) 1 h,取出,放冷,加甲醇至50 mL量瓶刻度,摇匀,滤过,取续滤液过0.45 µm的微孔滤膜,即得供试样品溶液。
-
每份样品随机剪取新鲜幼嫩的叶片,采用CTAB法[12]提取白芷DNA,基因组DNA用1×TE缓冲液将样品DNA浓度调至100 mg·L−1,并置于4 ℃冰箱保存。筛选出扩增结果稳定,重复性好的8对SRAP引物。PCR扩增反应体系为10 μL:模板DNA(100 mg·L−1)1 μL,5′端引物(10 μmol·L−1) 0.8 μL,3′端引物(10 μmol·L−1) 0.8 μL,Mix-Taq 6 μL,滴加ddH2O至10 μL。参考岑晓霞等[13]的方法进行扩增后,置于4 ℃冰箱保存。PCR扩增结束后,进行凝胶电泳,获取条带信息。
-
利用NTSYSpc 2.10e软件对样本进行聚类分析并绘制树状图。通过SPSS 23.0软件对数据进行整理分析,采用单因素方差分析法(one-way ANOVA)检验差异显著性;通过Origin软件,采用主成分分析法(PCA)[14]以降维方式提取主成分;通过中药指纹图谱相似度评价系统2004软件建立对照指纹图谱,计算样品的指纹图谱相似度。
-
筛选的8对SRAP引物共扩增82条条带,其中多态性条带有41条,多态性百分率为27.27%~80.00%,平均为50.00%,多态性最好的引物组合为Me4+Em8 (表2)。
表 2 不同SRAP引物扩增结果
Table 2. Statistical amplification results of different SRAP primers
引物组合 上/下游引物(5´→3´) 扩增条带数/条 多态性条带数/条 多态性百分率/% Me2+Em10 TGAGTCCAAACCGGAGC/GACTGCGTACGAATTTAG 8 4 50.00 Me2+Em15 TGAGTCCAAACCGGAGC/GACTGCGTACGAATTCTG 11 4 36.36 Me4+Em8 TGAGTCCAAACCGGACC/GACTGCGTACGAATTAGC 13 8 61.54 Me6+Em9 TGAGTCCAAACCGGTAG/GACTGCGTACGAATTACG 10 8 80.00 Me7+Em1 TGAGTCCAAACCGGTTG/GACTGCGTACGAATTAAT 7 2 28.57 Me8+Em5 TGAGTCCAAACCGGTGT/GACTGCGTACGAATTAAC 12 8 66.67 Me9+Em4 TGAGTCCAAACCGGTCA/GACTGCGTACGAATTTGA 11 3 27.27 Me11+Em1 TGAGTCCAAACCGGGTA/GACTGCGTACGAATTAAT 10 4 40.00 -
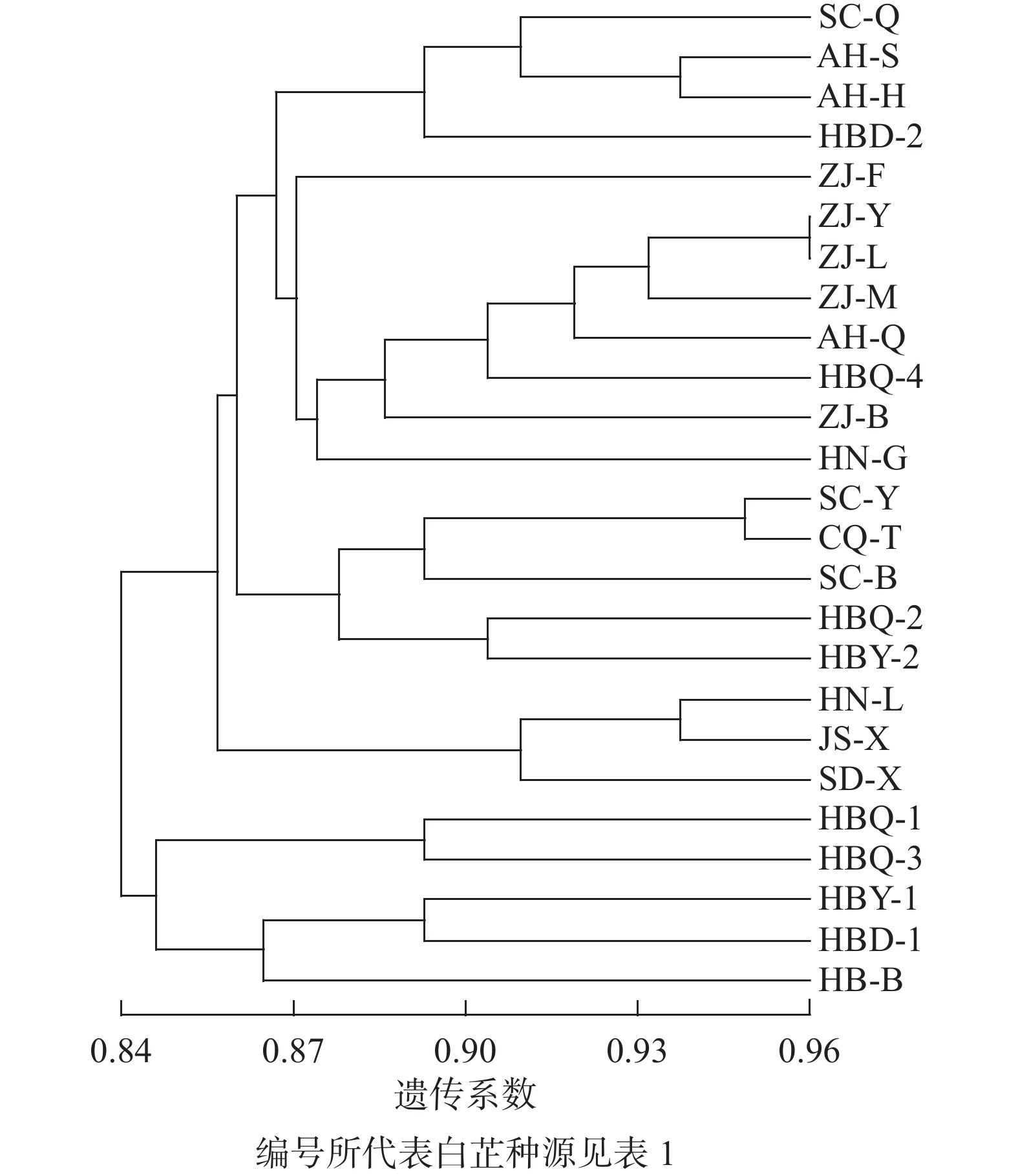
利用分子标记扩增的条带信息,以非加权组平均法(UPGMA)对25份白芷种源进行聚类。从图1可见:所有样本分为2个大类群,在遗传相似系数为0.84处,5个河北产区样本聚为一类。在遗传相似系数为0.87处,湖南、江苏、山东3个产区的样本单独聚为一类;四川、重庆、浙江和部分河北种源共同聚为一类。总体而言,浙江、四川和部分河北产区的样本基本各自聚为一类。本研究在河北和安徽产区采集的样本散布在浙江或四川产区的分类中,推测可能存在白芷种质资源引种行为。
-
取混合对照样品溶液2、4、6、8、10、12、14、16、20 µL注入液相色谱仪,记录峰面积,以峰面积(y)为纵坐标,以进样量(x, µg)为横坐标,进行线性回归,得到水合氧化前胡素、白当归素、佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素、花椒毒酚的线性回归方程(表3),判定系数R2均大于0.999,证明各化合物在线性范围内线性关系良好。对本研究建立的HPLC检测体系进行方法学考察,结果显示该方法合理可行。
表 3 白芷药材7种香豆素类化合物成分的线性关系
Table 3. Linear relationships of 7 coumarin compounds in A. dahurica
成分 回归方程 R2 进样量线
性范围/µg水合氧化前胡素 y=2 142.8x+2.253 6 0.999 8 0.026~0.256 白当归素 y=1 579.6x+1.568 1 0.999 7 0.009~0.090 佛手柑内酯 y=2 348.1x+0.191 3 0.999 7 0.012~0.115 氧化前胡素 y=2 396.7x-2.704 5 0.999 5 0.076~0.757 欧前胡素 y=2 628.2x-3.921 9 0.999 3 0.076~0.757 异欧前胡素 y=2 425.8x-0.257 4 0.999 5 0.029~0.290 花椒毒酚 y=3 183.2x+0.989 7 0.999 9 0.013~0.115 说明:y为峰面积,x为进样量(µg) -
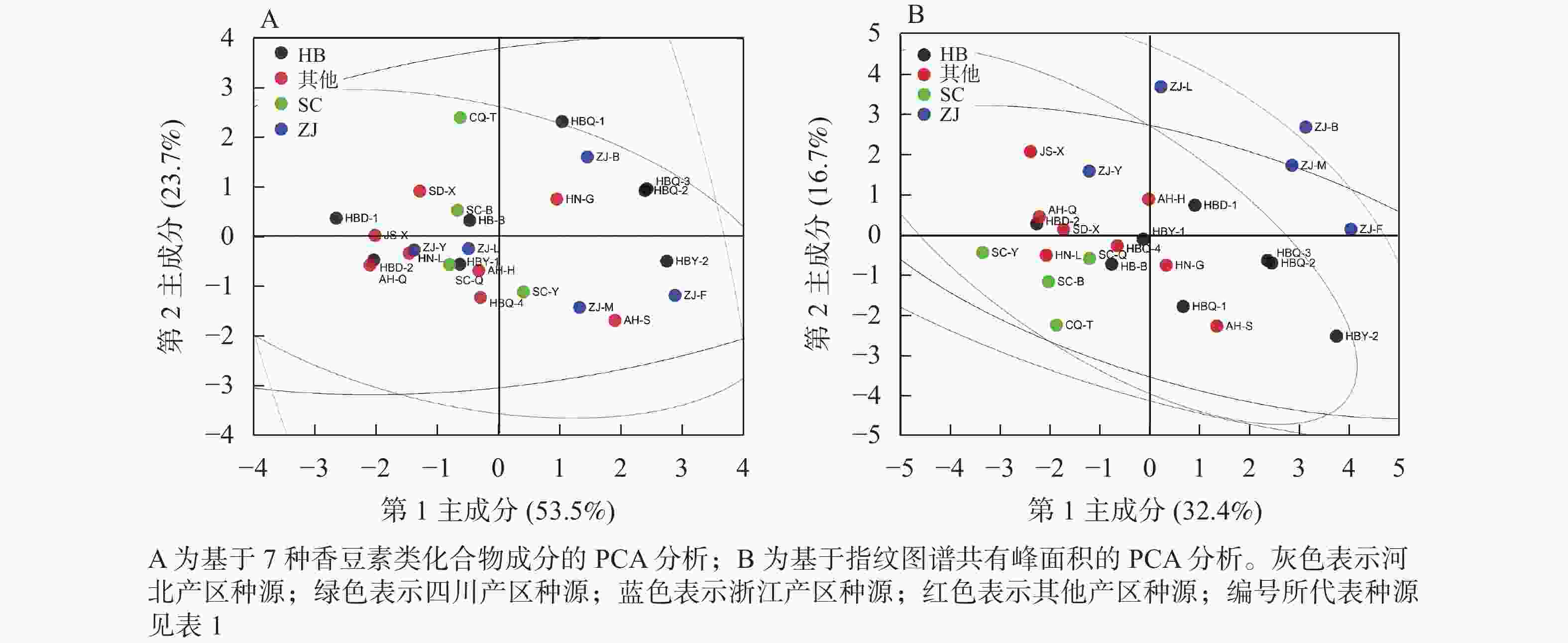
取25份同圃种植的白芷药材,应用HPLC法定量7种香豆素类成分。从表4可见:25份白芷种质资源的7种香豆素成分质量分数从高到低依次为欧前胡素、氧化前胡素、异欧前胡素、佛手柑内酯、水合氧化前胡素、白当归素、花椒毒酚,均值分别为2.428、1.404、0.806、0.317、0.181、0.057、0.007 mg·g−1。国家药典委员会规定白芷药材的欧前胡素质量分数不得少于0.080%[15],本研究中,资源圃25份白芷样品欧前胡素质量分数仅样品HBD-1未达国家药典委员会的标准,而样品AH-S、ZJ-F、ZJ-M欧前胡素质量分数表现突出,高于4 mg·g−1。对25份白芷药材的7种香豆素类化合物成分进行PCA分析(图2A),结果显示:第1主成分(PC1)解释了53.5%的方差,第2主成分(PC2)解释了23.7%的方差,2个主成分可解释原变量的77.2%的信息,可见,种源与成分组成没有明确规律。应用共有峰峰面积,对25份白芷样品进行PCA分析(图2B),结果显示:浙江种源的白芷材料与其他种源出现了一定的分离。
表 4 不同种源白芷的香豆素类成分和醇溶性浸出物特征
Table 4. Contents of coumarin components and ethanol-soluble extractives in A. dahurica
编号 香豆素成分质量分数/(mg·g−1) 醇溶性浸出物/% 水合氧化前胡素 白当归素 佛手柑内酯 氧化前胡素 欧前胡素 异欧前胡素 花椒毒酚 HBQ-1 0.348±0.010 a 0.178±0.009 b 0.501±0.007 e 1.866±0.014 d 1.667±0.009 m 0.521±0.019 q − 18.59±0.23 l HBQ-2 0.298±0.005 b 0.059±0.001 i 0.594±0.002 d 2.073±0.005 c 2.963±0.010 d 1.010±0.012 g − 27.01±0.32 fg HBQ-3 0.303±0.001 b 0.060±0.000 i 0.596±0.002 d 2.069±0.013 c 2.964±0.019 d 1.022±0.028 fg − 17.79±0.27 fg HBQ-4 0.137±0.003 j − 0.203±0.002 l 0.882±0.010 n 2.566±0.014 g 1.393±0.024 b − 20.12±0.23 ef HBY-1 0.129±0.030 jk 0.031±0.002 l 0.230±0.003 k 1.212±0.009 j 2.546±0.034 g 0.774±0.006 l − 20.13±0.65 gh HBY-2 0.160±0.001 h 0.158±0.002 c 0.647±0.004 b 2.197±0.005 b 2.033±0.005 j 1.753±0.008 a − 27.68±0.63 c HBD-1 0.136±0.002 j − 0.117±0.000 p 0.621±0.001 p 0.577±0.001 p 0.468±0.003 r − 20.36±0.32 l HBD-2 0.084±0.002 o 0.039±0.001 k 0.174±0.005 n 0.816±0.025 o 1.382±0.043 o 0.585±0.017 o − 20.03±0.46 n HB-B 0.224±0.000 e − 0.185±0.001 m 1.150±0.014 kl 2.252±0.000 i 0.863±0.002 j 0.045±0.000 c 23.56±0.04 d HN-G 0.270±0.001 d 0.045±0.001 j 0.260±0.001 j 1.811±0.003 e 2.797±0.005 e 0.951±0.004 i − 22.85±0.07 m JS-X 0.115±0.001 mn − 0.178±0.000 n 0.934±0.010 m 1.524±0.016 n 0.348±0.003 t − 19.83±0.02 a SD-X 0.193±0.010 f 0.064±0.002 h 0.283±0.014 h 1.170±0.047 k 1.416±0.055 o 0.293±0.013 u − 23.26±0.79 lm HN-L 0.087±0.004 o 0.036±0.001 k 0.226±0.000 k 1.132±0.014 l 1.425±0.004 o 0.625±0.002 n − 19.52±0.13 j ZJ-F 0.180±0.002 g 0.102±0.001 d 0.795±0.007 a 1.754±0.011 f 4.401±0.013 b 1.206±0.009 c 0.050±0.001 b 23.25±0.79 de ZJ-Y 0.110±0.001 n − 0.129±0.000 o 1.299±0.003 i 2.466±0.000 h 0.384±0.000 s − 21.76±0.16 l ZJ-M 0.124±0.002 kl 0.070±0.002 g 0.275±0.003 i 1.855±0.028 d 4.342±0.055 b 1.173±0.014 d 0.068±0.001 a 22.76±0.16 ij ZJ-L 0.158±0.004 h 0.098±0.003 e 0.340±0.004 f 1.156±0.011 kl 2.717±0.029 f 0.558±0.007 p − 24.24±0.11 b ZJ-B 0.288±0.005 c 0.205±0.003 a 0.313±0.003 g 2.339±0.022 a 1.844±0.019 k 0.970±0.005 h − 21.05±0.03 n SC-Q 0.146±0.002 i 0.029±0.001 l 0.124±0.007 o 1.140±0.094 kl 2.813±0.194 e 0.809±0.055 k − 22.17±0.00 d SC-B 0.222±0.007 e 0.071±0.008 g 0.334±0.005 f 0.953±0.019 m 1.746±0.012 l 0.704±0.002 m − 24.07±0.01 l SC-Y 0.127±0.001 kl − 0.312±0.003 g 1.396±0.005 h 3.392±0.022 c 1.035±0.006 f − 29.86±0.03 k CQ-T 0.348±0.001 a 0.076±0.000 f 0.110±0.000 q 1.490±0.009 g 1.381±0.008 o 0.464±0.009 r − 24.26±0.03 o AH-S 0.153±0.002 hi 0.066±0.005 h 0.603±0.015 c 1.511±0.040 g 5.685±0.183 a 0.763±0.021 l − 23.80±1.21 gh AH-H 0.119±0.001 lm 0.044±0.001 j 0.173±0.002 n 1.393±0.002 h 2.202±0.008 i 1.115±0.002 e − 22.45±0.01 hi AH-Q 0.060±0.001 p − 0.228±0.004 k 0.878±0.048 n 1.590±0.060 n 0.371±0.011 s − 18.39±0.18 d 说明:编号所代表种源见表1。−表示质量分数低,未检测出。同列不同小写字母表示差异显著(P<0.05)。醇溶性浸出物为质量分数 -
通过HPLC特征峰的指纹图谱数据分析,25份样品的色谱图如图3A所示,其中标定共有峰17个,如图3B所示。其中样品ZJ-L在27 min时有较强的吸收峰,其余样品在此处的吸收峰较小。另外,不同样品共有峰峰面积差异较大。
-
SRAP分子标记方便快速,不需要预先知道DNA顺序信息,结果稳定可靠,再现性高,重复性好,适合用于遗传多样性和亲缘关系等方面的研究[16]。对比其他药用植物群体的遗传组成研究结果,本研究表明:栽培白芷具有较好的遗传多样性,这可能与其有性繁殖的形式有关[17],不同产区白芷种源的遗传组成相近,种源间遗传分化较弱,这与侯凯等[7]的分析结果一致。与此同时,部分来自河北和安徽地区的白芷种源与南方杭白芷聚为一组,无明显区分,却与北方本地种源遗传差异较大,该聚类结果可能与不同产区白芷资源的种差异有关,而同为杭白芷种的四川种源与浙江种源分别聚集,可能与引种后的地理隔离有关[18]。与白芷类似,同为伞型科植物的前胡Peucedanum praeruptorum,同样因为人为引种导致栽培种的遗传分化变小[19]。李嘉惠等[20]基于SRAP分子标记构建何首乌Fallopia multiflora核心种质库,结果表明野生何首乌的遗传多样性比栽培居群的大,栽培居群间分化程度极高,但基因交流极小,说明栽培行为对遗传分化影响较大。
已有研究仅应用10份样本检测表明:不同产区间白芷药材的品质差异显著[4],也有研究对各产地白芷药材香豆素类成分分析表明:河南、河北与四川、安徽的白芷药材根据香豆素类成分差异被分为两类[20],而本研究增大了研究样本后发现:不同种源同圃栽培后品质没有明显的种源区别,这说明不同产区的环境因子可能是影响不同产区白芷品质差异的主要因素。同时,浙江传统产区的种源品质特征与其他主产区呈现出一定的差异性,即遗传分化体现在品质特征分化上,该结果可能是浙江的老产区多为个别农户留种小面积栽培,不与其他产区进行品种交流而导致的。
Genetic diversity and quality characteristics of Angelica dahurica in different producing areas
-
摘要:
目的 明确不同产区白芷Angelica dahurica种源遗传差异特征,分析具有遗传差异的白芷种源在同圃栽培条件下的品质特征差异。 方法 应用相关序列扩增多态性(SRAP)分子标记分析不同白芷种源的遗传组成,以同圃栽培的不同种源白芷为材料,应用高效液相色谱法(HPLC)测定7种香豆素类化学成分,构建HPLC指纹图谱,进而分析不同种源的品质特征。 结果 非加权组平均法(UPGMA)聚类分析显示:在遗传相似系数为0.84处,部分河北产区的白芷种源与南方产区的白芷种源产生分离。同圃栽培下,仅应用7种香豆素类化学成分不能明确区分不同白芷种源,应用HPLC指纹图谱进行主成分分析(PCA)后,具有遗传差异的种源之间出现品质特征的区分。 结论 不同产区白芷种源遗传相似度较大,同圃栽培的部分浙江白芷种源的药材可以应用HPLC指纹图谱与其他产地种源进行区分。图3表4参20 Abstract:Objective This study is to clarify the genetic differences of Angelica dahurica provenances in different producing areas in China, and analyze the quality characteristics of A. dahurica provenances with genetic differences under the same nursery cultivation conditions. Method The sequence-related amplified polymorphism (SRAP) molecular markers were used to analyze the genetic composition of different provenances of A. dahurica. Taking A. dahurica from different provenances cultivated in the same nursery as materials, the chemical components of 7 coumarins were determined by high performance liquid chromatography (HPLC), and HPLC fingerprints were constructed to analyze the quality characteristics of different provenances. Result Unweighted pair-group method with arithmetic means (UPGMA) showed that some provenances of A. dahurica from Hebei Province and those from South China were separated at the similarity coefficient of 0.84. Under the same nursery cultivation conditions, only 7 coumarins could not be used to clearly distinguish different provenances of A. dahurica. After principal component analysis (PCA) by HPLC fingerprint, the quality characteristics were differentiated between provenances. Conclusion The genetic similarity of A. dahurica provenances from different producing areas is relatively large, and the medicinal materials from some Zhejiang A. dahurica provenances cultivated in the same nursery can be distinguished from those from other producing areas by HPLC fingerprint. [Ch, 3 fig. 4 tab. 20 ref.] -
Key words:
- Angelica dahurica /
- SRAP /
- genetic /
- coumarins /
- quality
-
表 1 供试白芷种源信息
Table 1. Information of tested materials of A. dahurica
编号 来源 种质类型 基原 纬度(N) 经度(E) 海拔/m HBQ-1 河北省保定市安国市祁州镇-1 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 33 HBQ-2 河北省保定市安国市祁州镇-2 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 32 HBQ-3 河北省保定市安国市祁州镇-3 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 33 HBQ-4 河北省保定市安国市祁州镇-4 本地栽培 白芷 38°25′11.79″ 115°18′54.12″ 32 HBY-1 河北省保定市安国市易州镇-1 本地栽培 白芷 39°20′43.56″ 115°30′06.04″ 50 HBY-2 河北省保定市安国市易州镇-2 本地栽培 白芷 39°20′43.56″ 115°30′06.04″ 45 HBD-1 河北省保定市安国市大五女镇-1 本地栽培 白芷 38°22′16.83″ 115°12′54.73″ 37 HBD-2 河北省保定市安国市大五女镇-2 本地栽培 白芷 38°22′16.83″ 115°12′54.73″ 36 HB-B 河北省保定市安国市北段村乡 本地栽培 白芷 38°28′13.34″ 115°17′48.67″ 30 HN-G 河南省许昌市禹州市古城镇 本地栽培 白芷 34°13′37.53″ 113°33′44.31″ 169 JS-X 江苏省宿迁市沭阳县新河镇 引种栽培 白芷 34°10′55.57″ 118°39′35.60″ 16 SD-X 山东省烟台市莱阳市穴坊镇 引种栽培 白芷 36°40′02.15″ 120°43′52.90″ 37 HN-L 湖南省邵阳市邵东县廉桥镇 引种栽培 白芷 27°19′25.00″ 111°50′56.70″ 208 ZJ-F 浙江省杭州市淳安县枫树岭镇 本地栽培 杭白芷 29°22′04.26″ 118°42′34.62″ 370 ZJ-Y 浙江省金华市磐安县新渥镇(仰头村) 本地栽培 杭白芷 28°58′28.49″ 120°25′47.97″ 560 ZJ-M 浙江省金华市磐安县新渥镇(麻车下村岩岗) 本地栽培 杭白芷 28°59′27.89″ 120°23′13.20″ 570 ZJ-L 浙江省金华市磐安县冷水镇 本地栽培 杭白芷 28°53′59.36″ 120°20′59.61″ 303 ZJ-B 浙江省台州市仙居县白塔镇 本地栽培 杭白芷 28°44′59.86″ 120°36′04.52″ 78 SC-Q 四川省遂宁市蓬溪县群利镇 本地栽培 杭白芷 30°22′59.82″ 105°58′30.98″ 338 SC-B 四川省遂宁市蓬溪县宝梵镇 本地栽培 杭白芷 30°40′58.73″ 105°41′06.79″ 408 SC-Y 四川省遂宁市船山区永兴镇 本地栽培 杭白芷 30°33′51.02″ 105°36′27.35″ 293 CQ-T 重庆市大足区铁山镇 本地栽培 杭白芷 29°41′10.54″ 105°34′01.12″ 417 AH-S 安徽省亳州市谯城区十九里镇 引种栽培 杭白芷 33°48′38.23″ 115°47′15.30″ 39 AH-H 安徽省亳州市谯城区华佗镇 引种栽培 杭白芷 33°56′03.63″ 115°46′48.82″ 39 AH-Q 安徽省亳州市谯城区谯东镇 引种栽培 杭白芷 33°50′53.42″ 115°52′33.24″ 37 表 2 不同SRAP引物扩增结果
Table 2. Statistical amplification results of different SRAP primers
引物组合 上/下游引物(5´→3´) 扩增条带数/条 多态性条带数/条 多态性百分率/% Me2+Em10 TGAGTCCAAACCGGAGC/GACTGCGTACGAATTTAG 8 4 50.00 Me2+Em15 TGAGTCCAAACCGGAGC/GACTGCGTACGAATTCTG 11 4 36.36 Me4+Em8 TGAGTCCAAACCGGACC/GACTGCGTACGAATTAGC 13 8 61.54 Me6+Em9 TGAGTCCAAACCGGTAG/GACTGCGTACGAATTACG 10 8 80.00 Me7+Em1 TGAGTCCAAACCGGTTG/GACTGCGTACGAATTAAT 7 2 28.57 Me8+Em5 TGAGTCCAAACCGGTGT/GACTGCGTACGAATTAAC 12 8 66.67 Me9+Em4 TGAGTCCAAACCGGTCA/GACTGCGTACGAATTTGA 11 3 27.27 Me11+Em1 TGAGTCCAAACCGGGTA/GACTGCGTACGAATTAAT 10 4 40.00 表 3 白芷药材7种香豆素类化合物成分的线性关系
Table 3. Linear relationships of 7 coumarin compounds in A. dahurica
成分 回归方程 R2 进样量线
性范围/µg水合氧化前胡素 y=2 142.8x+2.253 6 0.999 8 0.026~0.256 白当归素 y=1 579.6x+1.568 1 0.999 7 0.009~0.090 佛手柑内酯 y=2 348.1x+0.191 3 0.999 7 0.012~0.115 氧化前胡素 y=2 396.7x-2.704 5 0.999 5 0.076~0.757 欧前胡素 y=2 628.2x-3.921 9 0.999 3 0.076~0.757 异欧前胡素 y=2 425.8x-0.257 4 0.999 5 0.029~0.290 花椒毒酚 y=3 183.2x+0.989 7 0.999 9 0.013~0.115 说明:y为峰面积,x为进样量(µg) 表 4 不同种源白芷的香豆素类成分和醇溶性浸出物特征
Table 4. Contents of coumarin components and ethanol-soluble extractives in A. dahurica
编号 香豆素成分质量分数/(mg·g−1) 醇溶性浸出物/% 水合氧化前胡素 白当归素 佛手柑内酯 氧化前胡素 欧前胡素 异欧前胡素 花椒毒酚 HBQ-1 0.348±0.010 a 0.178±0.009 b 0.501±0.007 e 1.866±0.014 d 1.667±0.009 m 0.521±0.019 q − 18.59±0.23 l HBQ-2 0.298±0.005 b 0.059±0.001 i 0.594±0.002 d 2.073±0.005 c 2.963±0.010 d 1.010±0.012 g − 27.01±0.32 fg HBQ-3 0.303±0.001 b 0.060±0.000 i 0.596±0.002 d 2.069±0.013 c 2.964±0.019 d 1.022±0.028 fg − 17.79±0.27 fg HBQ-4 0.137±0.003 j − 0.203±0.002 l 0.882±0.010 n 2.566±0.014 g 1.393±0.024 b − 20.12±0.23 ef HBY-1 0.129±0.030 jk 0.031±0.002 l 0.230±0.003 k 1.212±0.009 j 2.546±0.034 g 0.774±0.006 l − 20.13±0.65 gh HBY-2 0.160±0.001 h 0.158±0.002 c 0.647±0.004 b 2.197±0.005 b 2.033±0.005 j 1.753±0.008 a − 27.68±0.63 c HBD-1 0.136±0.002 j − 0.117±0.000 p 0.621±0.001 p 0.577±0.001 p 0.468±0.003 r − 20.36±0.32 l HBD-2 0.084±0.002 o 0.039±0.001 k 0.174±0.005 n 0.816±0.025 o 1.382±0.043 o 0.585±0.017 o − 20.03±0.46 n HB-B 0.224±0.000 e − 0.185±0.001 m 1.150±0.014 kl 2.252±0.000 i 0.863±0.002 j 0.045±0.000 c 23.56±0.04 d HN-G 0.270±0.001 d 0.045±0.001 j 0.260±0.001 j 1.811±0.003 e 2.797±0.005 e 0.951±0.004 i − 22.85±0.07 m JS-X 0.115±0.001 mn − 0.178±0.000 n 0.934±0.010 m 1.524±0.016 n 0.348±0.003 t − 19.83±0.02 a SD-X 0.193±0.010 f 0.064±0.002 h 0.283±0.014 h 1.170±0.047 k 1.416±0.055 o 0.293±0.013 u − 23.26±0.79 lm HN-L 0.087±0.004 o 0.036±0.001 k 0.226±0.000 k 1.132±0.014 l 1.425±0.004 o 0.625±0.002 n − 19.52±0.13 j ZJ-F 0.180±0.002 g 0.102±0.001 d 0.795±0.007 a 1.754±0.011 f 4.401±0.013 b 1.206±0.009 c 0.050±0.001 b 23.25±0.79 de ZJ-Y 0.110±0.001 n − 0.129±0.000 o 1.299±0.003 i 2.466±0.000 h 0.384±0.000 s − 21.76±0.16 l ZJ-M 0.124±0.002 kl 0.070±0.002 g 0.275±0.003 i 1.855±0.028 d 4.342±0.055 b 1.173±0.014 d 0.068±0.001 a 22.76±0.16 ij ZJ-L 0.158±0.004 h 0.098±0.003 e 0.340±0.004 f 1.156±0.011 kl 2.717±0.029 f 0.558±0.007 p − 24.24±0.11 b ZJ-B 0.288±0.005 c 0.205±0.003 a 0.313±0.003 g 2.339±0.022 a 1.844±0.019 k 0.970±0.005 h − 21.05±0.03 n SC-Q 0.146±0.002 i 0.029±0.001 l 0.124±0.007 o 1.140±0.094 kl 2.813±0.194 e 0.809±0.055 k − 22.17±0.00 d SC-B 0.222±0.007 e 0.071±0.008 g 0.334±0.005 f 0.953±0.019 m 1.746±0.012 l 0.704±0.002 m − 24.07±0.01 l SC-Y 0.127±0.001 kl − 0.312±0.003 g 1.396±0.005 h 3.392±0.022 c 1.035±0.006 f − 29.86±0.03 k CQ-T 0.348±0.001 a 0.076±0.000 f 0.110±0.000 q 1.490±0.009 g 1.381±0.008 o 0.464±0.009 r − 24.26±0.03 o AH-S 0.153±0.002 hi 0.066±0.005 h 0.603±0.015 c 1.511±0.040 g 5.685±0.183 a 0.763±0.021 l − 23.80±1.21 gh AH-H 0.119±0.001 lm 0.044±0.001 j 0.173±0.002 n 1.393±0.002 h 2.202±0.008 i 1.115±0.002 e − 22.45±0.01 hi AH-Q 0.060±0.001 p − 0.228±0.004 k 0.878±0.048 n 1.590±0.060 n 0.371±0.011 s − 18.39±0.18 d 说明:编号所代表种源见表1。−表示质量分数低,未检测出。同列不同小写字母表示差异显著(P<0.05)。醇溶性浸出物为质量分数 -
[1] 王梦月, 贾敏如. 白芷的功效考证[J]. 上海中医药杂志, 2004, 38(10): 56 − 57. WANG Mengyue, JIA Minru. Herbological study on the functions of radix angelicae dahuricae [J]. Shanghai Journal of Traditional Chinese Medicine, 2004, 38(10): 56 − 57. [2] 吉庆, 马宇衡, 张烨. 白芷的化学成分及药理作用研究进展[J]. 食品与药品, 2020, 22(6): 509 − 514. JI Qing, MA Yuheng, ZHANG Ye. Research progress on chemical constituents and pharmacological effects of angelicae dahuricae radix [J]. Food and Drug, 2020, 22(6): 509 − 514. [3] 李乾, 刘洁, 李月婷, 等. UPLC-FLD法同时测定不同产地白芷中5种香豆素[J]. 中成药, 2020, 42(9): 2357 − 2362. LI Qian, LIU Jie, LI Yueting, et al. Simultaneous determination of five coumarins in angelicae dahuricae radix from different growing areas by UPLC-FLD [J]. Chinese Traditional Patent Medicine, 2020, 42(9): 2357 − 2362. [4] 陈琳, 唐志书, 宋忠兴, 等. 不同产地白芷药材9个呋喃香豆素成分的含量测定及其质量评价[J]. 中国中药杂志, 2019, 44(14): 3002 − 3009. CHEN Lin, TANG Zhishu, SONG Zhongxing, et al. Quantitative determination of nine furanocoumarins for quality evaluation of Angelica dahurica from different habitats [J]. China Journal of Chinese Materia Medica, 2019, 44(14): 3002 − 3009. [5] YU Mingguang, LI Ting, RAZA A, et al. Sensory-guided identification of bitter compounds in Hangbaizhi (Angelica dahurica)[J/OL]. Food Research Intermational, 2019, 129: 108880[2022-05-20]. doi: 10.1016/j.foodres.2019.108880. [6] 刘倩倩, 叶浩婷, 李放, 等. 杭白芷种质资源遗传多样性的SSR分析[J]. 南方农业学报, 2018, 49(3): 418 − 423. LIU Qianqian, YE Haoting, LI Fang, et al. SSR analysis for genetic diversity of Angelica dahurica var. formosana [J]. Journal of Southern Agriculture, 2018, 49(3): 418 − 423. [7] 侯凯, 吴卫, 郑有良, 等. 川产白芷遗传多样性的ISSR分析[J]. 四川农业大学学报, 2008, 26(3): 237 − 240. HOU Kai, WU Wei, ZHENG Youliang, et al. Genetic diversity of angelicae dahuricae accessions from Sichuan Province by inter-simple sequence repeat (ISSR) [J]. Journal of Sichuan Agricultural University, 2008, 26(3): 237 − 240. [8] LI G, QUIROS C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theoretical and Applied Genetics, 2001, 103: 455 − 461. [9] 刘宝, 范辉华, 彭珠清, 等. 不同地理种源无患子的分子多态性分析[J]. 浙江农林大学学报, 2014, 31(1): 151 − 155. LIU Bao, FAN Huihua, PENG Zhuqing, et al. Molecular polymorphic analysis with geographic provenances of Sapindus mukorossi [J]. Journal of Zhejiang A&F University, 2014, 31(1): 151 − 155. [10] 赵瑞强. 基于分子标记的铁皮石斛种质资源遗传多样性研究[D]. 杭州: 浙江农林大学, 2012. ZHAO Ruiqiang. Study of Genetic Diversity based on Molecular Marker in Germplasms Resources of Dendrobium offcinale [D]. Hangzhou: Zhejiang A&F University, 2012. [11] 谢楠, 刘志荣, 张明童, 等. 高效液相色谱法测定白芷中9种香豆素类化学成分的含量及其多元统计分析[J]. 理化检验-化学分册, 2022, 58(6): 657 − 663. XIE Nan, LIU Zhirong, ZHANG Mingtong, et al. Determination of 9 chemical components of coumarins in Angelica dahurica by high performance liquid chromatography and its multivariate statistical analysis [J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis) , 2022, 58(6): 657 − 663. [12] 王艳, 成金乐. 改进的CTAB法提取32种中药破壁饮片DNA及物种鉴定[J]. 中国中医药现代远程教育, 2018, 16(22): 89 − 91, 130. WANG Yan, CHENG Jinle. Extraction of DNA from 32 kinds of Chinese herbal pieces by improved CTAB method and species identification [J]. Chinese Medicine Modern Distance Education of China, 2018, 16(22): 89 − 91, 130. [13] 岑晓霞, 孙健, 沈晓霞, 等. 基于SRAP和ISSR标记的栽培麦冬起源和遗传多样性研究[J]. 中药材, 2021, 44(3): 555 − 561. CEN Xiaoxia, SUN Jian, SHEN Xiaoxia et al. Study on origin and genetic diversity of cultivated of Ophiopogon japonicus based on SRAP and ISSR markers [J]. Journal of Chinese Medicinal Materials, 2021, 44(3): 555 − 561. [14] 尹燕, 王淼, 阳志强, 等. 化学模式识别在中药炮制中的应用[J]. 中草药, 2021, 52(17): 5369 − 5377. YIN Yan, WANG Miao, YANG Zhiqiang, et al. Application of chemical pattern recognition in processing of Chinese materia medica [J]. Chinese Traditional and Herbal Drugs, 2021, 52(17): 5369 − 5377. [15] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia (Volume Ⅰ) [M]. Beijing: China Medical Science Press, 2020. [16] 周治淼. 广东茶树种质资源遗传多样性的SRAP研究[D]. 长沙: 湖南农业大学, 2008. ZHOU Zhimiao. Studies on Genetic Diversity of Tea Germplasms [Camellia sinensis (L.) O. Kuntze] in Guangdong Province by SRAP Technology[D]. Changsha: Hunan Agricultural University, 2008. [17] 陈郡雯, 吴卫, 侯凯, 等. 川白芷与祁白芷花粉活力及柱头可授性测定[J]. 中国中药杂志, 2011, 36(22): 3079 − 3082. CHEN Junwen, WU Wei, HOU Kai, et al. Pollen viability and stigma receptivity of Angelica dahurica from Sichuan and Hebei Province [J]. China Journal of Chinese Materia Medica, 2011, 36(22): 3079 − 3082. [18] 王丽赟, 孙健, 沈宇峰, 等. 我国主要产区白芷的基原和群体遗传组成特征分析[J]. 中药材, 2022, 45(4): 830 − 835. WANG Liyun, SUN Jian, SHEN Yufeng, et al. Analysis of botanical origin and genetic composition of Angelica dahurica in China’s main producing areas [J]. Journal of Chinese Medicinal Materials, 2022, 45(4): 830 − 835. [19] 周介仁, 孙健, 沈晓霞, 等. 白花前胡传统产区种质资源的遗传多样性研究[J]. 中药材, 2021, 44(11): 2543 − 2548. ZHOU Jieren, SUN Jian, SHEN Xiaoxia, et al. Study on genetic diversity of Peucedanum praeruptorum germplasm resources in traditional production areas [J]. Journal of Chinese Medicinal Materials, 2021, 44(11): 2543 − 2548. [20] 李嘉惠, 欧晓华, 邓文静, 等. 基于SRAP分子标记构建何首乌核心种质库[J]. 广西植物, 2021, 41(11): 1920 − 1930. LI Jiahui, OU Xiaohua, DENG Wenjing, et al. Construction of core germplasm bank of Fallopia multiflora using SRAP molecular markers [J]. Guihaia, 2021, 41(11): 1920 − 1930. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20220427







 下载:
下载: