-
土壤呼吸又被称为土壤二氧化碳(CO2)排放通量,是土壤中的碳以CO2形式从土壤向大气圈流动的结果,是陆地生态系统碳循环中一个重要环节[1]。土壤中的碳储量约1 500 Gt,超过了植被(约560 Gt)和大气含量(约750 Gt)的总和[2]。全球每年因土壤呼吸作用向大气中释放的CO2量约是77 Pg,其量值仅次于全球陆地总初级生产力,是化石燃料燃烧所产生的CO2的10倍[3-4],是碳进入大气系统的主要途径之一[5]。因此,土壤呼吸的一些细小变化都会对大气的CO2浓度产生影响,进而造成全球性的气候变化。土壤呼吸受植被类型、土壤温度、湿度、养分、微生物等因素的交互影响[6-9]。有研究表明:土壤温度和土壤呼吸速率之间存在着明显的指数相关关系[10-11],土壤呼吸对温度变化的敏感性则通常用Q10表示,即温度每升高10 ℃土壤呼吸的变化倍数[12]。土壤湿度对土壤呼吸的影响十分显著,在干旱半干旱地区土壤湿度甚至成为影响土壤呼吸的主要控制因子[13],而在元江干热河谷这种干热的特殊环境下对土壤呼吸特征及其调控因子等方面的研究还尚不明确。热带与亚热带的萨王纳生态系统占据了全球陆地面积的1/6,占据陆地生态系统净初级生产力的30%[14-15],因而,萨王纳生态系统对全球的物质循环、气候变化等方面都至关重要,另外,根据相关研究:萨王纳生态系统是全球温室气体主要的排放源之一[16-18]。在中国,萨王纳系统主要表现为干热河谷的稀树灌草丛生态系统,元江干热河谷就是中国萨王纳生态系统的典型代表,该系统因复杂的地理环境和局部小气候的综合作用形成了独特的干热生境:焚风盛行,年均气温20 ℃以上,降水量小,蒸发量大[19-21]。目前中国对于干热河谷稀树灌草丛生态系统土壤呼吸的相关研究和报道还很鲜见,本研究利用实测数据,探究了干热河谷稀树灌草丛生态系统土壤呼吸的特征和变化规律,及其与土壤温度和土壤湿度的相关关系,计算该生态系统土壤CO2年排放量和Q10。可为国家温室气体清单估算提供基础数据;为进一步预测气候变化对干热河谷稀树灌草丛生态系统土壤呼吸的影响提供参考。
-
监测样地位于云南省元江县普漂村的元江国家级自然保护区试验区内,距离元江县城约25 km。样地建在中国科学院西双版纳热带植物园元江干热河谷生态系统研究站1 hm2永久样地旁,海拔570 m,23°28′N,102°10′E,地形相对平坦,土壤类型为燥红壤,0~20 cm土壤有机质质量分数为1.2%,pH 7.3(土水比为1.0∶2.5)。50 a(1965−2014)年平均气温23.8 ℃,最冷月平均气温16.7 ℃,最热月平均气温28.6 ℃,≥10 ℃年积温达8 708.9 ℃;干湿季节分明,干季为11月至翌年4月,雨季为5−10月;50 a年平均降水799.9 mm,其中79.2%的降水集中在雨季[22]。群落林冠高度约6 m,优势种为厚皮树Lannea coromandelica、霸王鞭Euphorbia royleana、老人皮Polyalthia cerasoides、余甘子Phyllanthus emblica;灌丛高度一般在1~3 m,优势种为虾子花Woodfordia fruticosa、云南黄素馨Jasminum mesnyi;草本主要以多年生禾本科Poaceae植物扭黄茅Heteropogon contortus为优势种[23-24]。
-
考虑该区域植被状况及代表性,在中国科学院西双版纳热带植物园元江干热河谷生态站的取样样地中选取5块10 m×10 m的典型样地,每个典型样地间相距10 m,在每块样地中分别放置3个采样桶,共计15个采样桶。采样桶为圆柱形聚氯乙烯(PVC)桶,桶高为20 cm,直径15 cm,每个小桶配1个底座,底座高5 cm,实验前1个月安置采样桶,采样桶底座压入土中,并长期保留在样地中。桶盖用惰性PVC板制作而成,桶盖上打有3个直径5 mm的圆孔,小孔用来插接进、出气管和电子温度计。测量时用黏胶和橡皮泥将桶盖密封在桶身上。
-
土壤呼吸:采用红外CO2分析法,测定土壤呼吸中的CO2成分,测定仪器为Li-820(Li-Cor,美国)。每次测定前24 h,齐地剪去地表植物,去除植被的光合作用和呼吸作用对土壤呼吸的影响[25-27]。测定时间为8:30−11:00,实验前先预热仪器约30 min,测量时收集有效数据2 min。从2014年6月下旬开始测量至2015年6月上旬结束,每月测定2次(上半月下半月各1次,间隔10 d以上),每季度用标气校正Li-820[28]。
环境因子测定:测定土壤呼吸的同时,采用长杆温度计在气室顶部小孔插入测定气室温度,在采样桶周围10 cm内埋设HOBO温度采集器,测定5、10 cm处土壤温度。采用TDR 100土壤水分速测仪测定采样桶周边0~5、0~10 cm土壤体积含水量,简称5、10 cm土壤湿度。
-
$$ {F=}\frac{{M}}{{{V}}_{{0}}}\frac{{P}}{{{P}}_{{0}}}\frac{{{T}}_{{0}}}{{T}}{H}\frac{{{d}}_{{c}}}{{{d}}_{{t}}}\text{。}$$ (1) 式(1)中:F为CO2通量(mg·m−2·h−1),M为CO2摩尔质量(g·mol−1),P0和T0为理想气体标准状态下的空气压力和气温(分别为1 013.25 hPa和273.15 K),V0为CO2在标准状态下的摩尔体积,即22.41 L·mol−1,H为采样箱内气室高度(m),P和T为采样时箱内的实际气压(hPa)和气温(℃),dc
/dt 为桶内CO2浓度随时间变化的回归曲线斜率。年通量计算:把干季、雨季和全年观测的土壤呼吸速率的分别进行平均计算,分别作为观测期内干季、雨季和全年的日平均值,根据干季、雨季的天数计算得到干季、雨季和全年通量。 -
土壤温度和土壤呼吸的关系采用指数方程进行拟合[29]:
$$ {R}_{\rm{S}}{=}{{a}}_{{1}}{\rm{exp}}\;({b_{1}{T}})\text{。} $$ (2) Q10计算方程为:
$$ {{Q}}_{{10}}{=}{\rm{exp}}{(}{10}{{b}}_{{1}}{)}\text{。} $$ (3) 土壤湿度和土壤呼吸的关系采用二次曲线进行拟合[30]:
$$ {R}_{\rm{S}}{=}{{a}}_{{2}}{{W}}^{{2}}{+}{{b}}_{{2}}{W+}{{c}}_{{1}}\text{。} $$ (4) 土壤温度和湿度和土壤呼吸的关系采用指数与二次耦合方程拟合[30]:
$$ {R}_{\rm{S}}{=}{{a}}_{{3}}\left({d}{{W}}^{{2}}{+}{k}{W+}{{c}}_{{2}}{}\right){\rm{exp}}\;({b_{3}{T}})\text{。} $$ (5) 式(2)~(5)中:RS为土壤呼吸速率(μmol·m−2·s−1),T为 5、10 cm处土壤温度(℃),W为5、10 cm土壤湿度(%),a1、a2、a3、b1、b2、b3、c1、c2、d和k为拟合常数。
全年计算方法:实验开始于2014年6月22日,结束于2015年6月16日,因此为了与历史气象数据以及元江干季和雨季配合,本研究设定6月22日为起始日,次年6月21日为结束日,11月1日为干季起始日,次年4月30日为干季结束日,雨季为全年去除干季的部分。本研究历史气候数据都是依照这个方法进行计算。
-
使用SigmaPlot 12.0对土壤呼吸与温度和土壤湿度的关系进行拟合并作图,显著性水平为0.05。
-
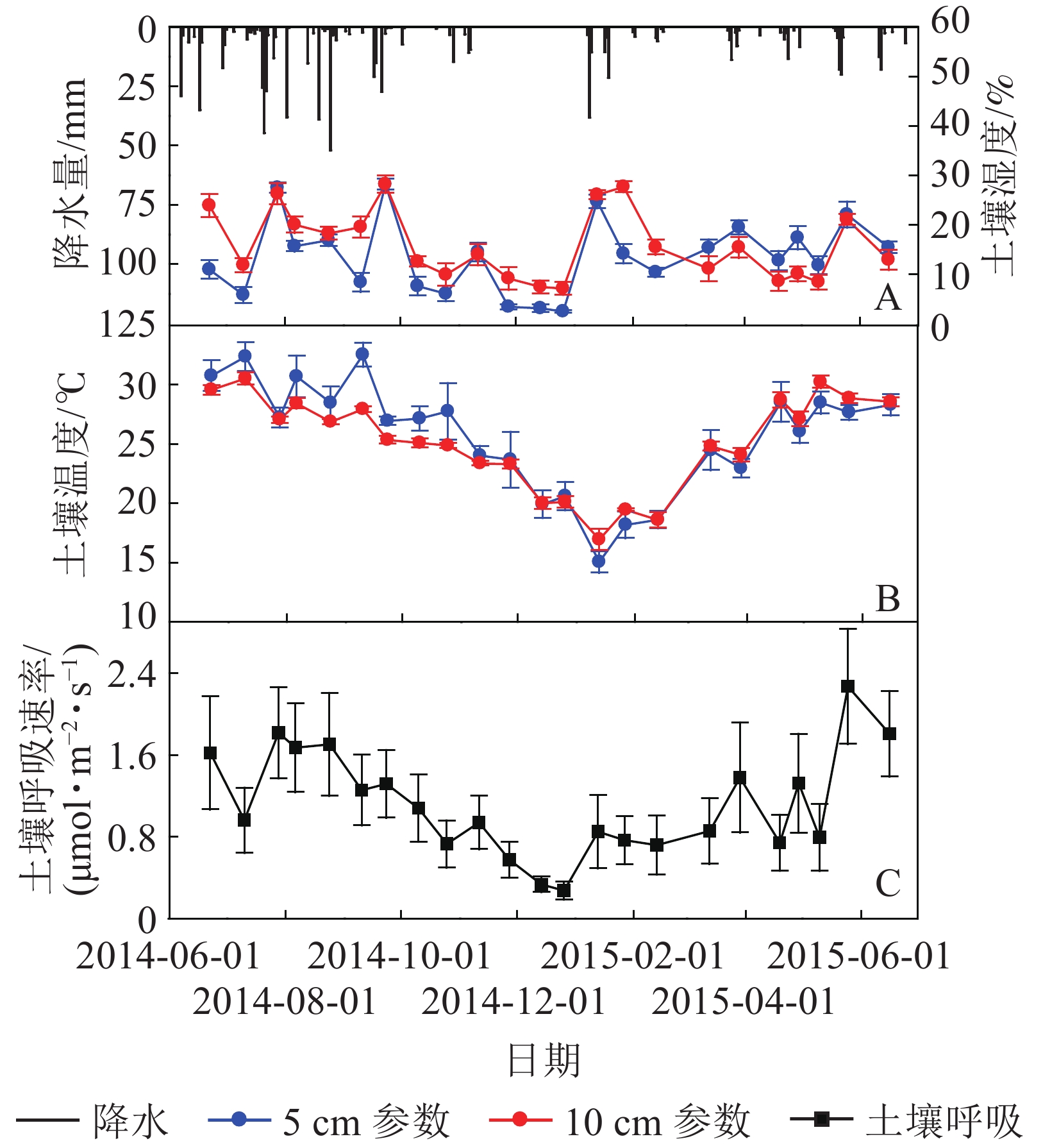
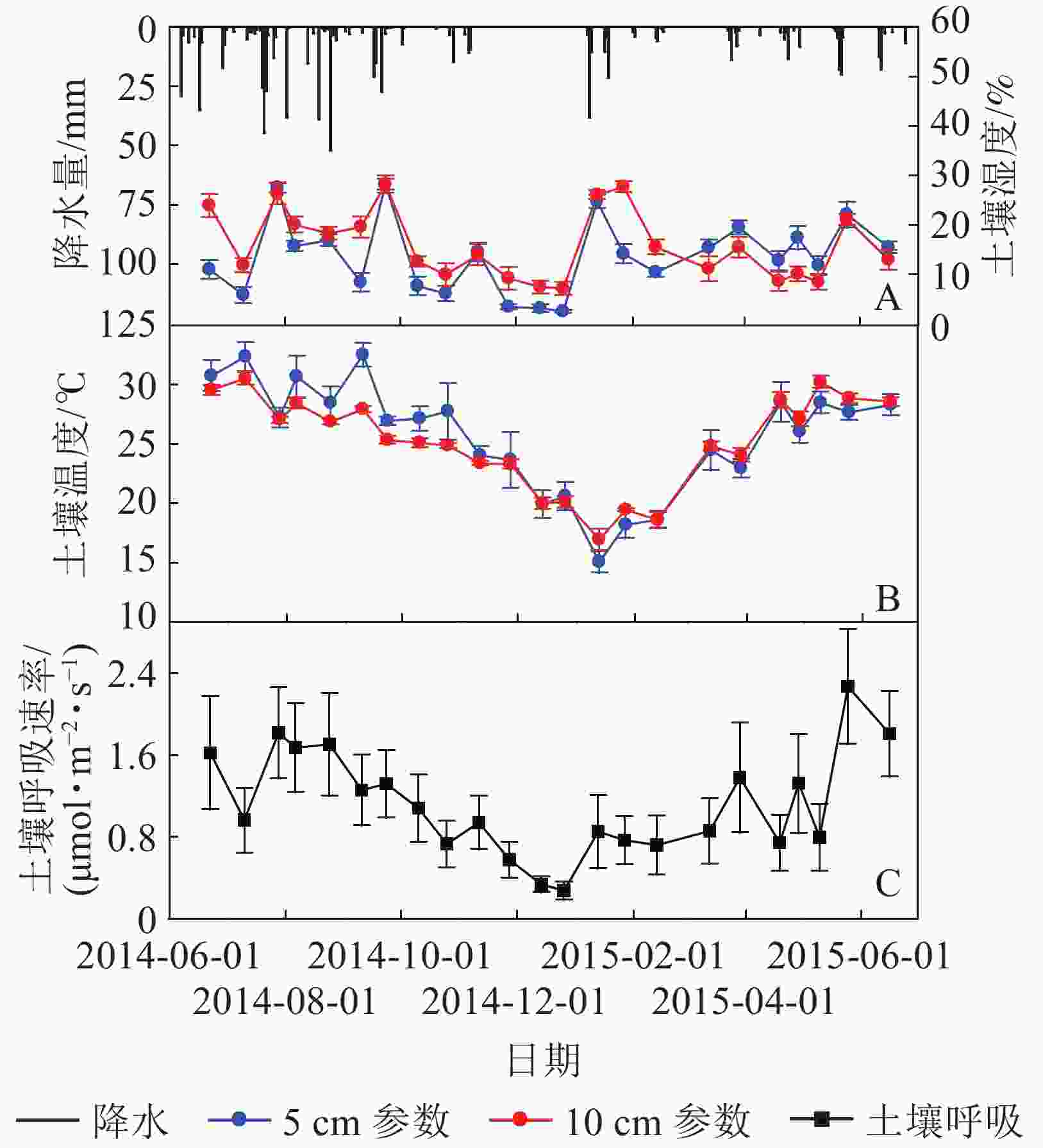
测定期间内元江干热河谷稀树灌草丛生态系统的总降水量为718.3 mm,较元江50 a(1965−2014)平均降水量799.9 mm减少10.2%(表1)。其中雨季降水量为515.2 mm,占测定周期总降水量的71.7%,少于50 a平均值79.2%;干季的降水量为203.1 mm,占测定周期总降水量的28.3%,多于50年平均值20.8%。
表 1 干季、雨季和全年降水、土壤呼吸总量和土壤温度、湿度日均值
Table 1. Total value of precipitation and soil respiration, daily mean values soil temperature, soil water content in the dry season, the rain season and annual respectively
时期 土壤温度/℃ 土壤湿度/% 土壤呼吸总量/(t·hm−2) 降水/mm 5 cm 10 cm 5 cm 10 cm 干季 22.0±1.2 B 22.4±0.5 B 12.5±0.9 B 13.8±1.2 B 1.49±0.53 B 203.1 雨季 29.0±1.1 A 27.8±0.4 A 14.7±1.1 A 17.8±1.0 A 2.71±0.76 A 515.2 年 25.7±1.2 25.2±0.4 13.7±1.0 15.9±1.1 4.20±1.30 718.3 说明:数值为平均值±标准误,同列不同大写字母表示同一指标不同时期在0.01水平差异显著 如图1所示:元江干热河谷稀树灌草丛生态系统土壤5、10 cm处温度和湿度具有明显的季节变化,均呈现出雨季极显著高于干季的变化规律(表1)。5、10 cm处土壤温度的最低值均出现在1月,分别为15.1和16.9 ℃,随后逐渐升高,最高值出现在雨季的7−9月(图1B),分别为32.5 ℃(9月)和30.5 ℃(7月)。5、10 cm土壤湿度的最低值均出现在干季初期12月,分别为2.5%和7.1%,随后逐渐升高,最高值均出现在雨季后期的9月(图1A),分别为28.1%和28.2%。
-
元江干热河谷稀树灌草丛土壤呼吸具有明显的季节变化,土壤呼吸速率总体呈现近似单峰型且雨季大于干季(图1C)。1−6月,随着温度的上升和降水量的逐渐增加,土壤呼吸速率也随之逐渐增加;在温度较高,降水相对稳定的6−9月,土壤呼吸速率也维持在一个相对稳定的较高水平,并且在雨季初期的2015年5月出现土壤呼吸速率峰值,为2.27 μmol·m−2·s−1;9月之后,随着温度的降低和降水量的逐渐减少,土壤呼吸速率总体上也随之减弱,到12月降水量降到最小值,土壤呼吸速率也在此时出现最低值,为0.27 μmol·m−2·s−1。经过计算,元江干热河谷稀树灌草丛生态系统土壤呼吸年总量为4.20 t·hm−2·a−1,其中,雨季的CO2排放量2.71 t·hm−2,占到全年碳排放总量的64.5%,干季的CO2排放量1.49 t·hm−2,占到全年碳排放总量的35.5%(表1),通过1 a的观测研究,元江干热河谷稀树灌草丛土壤呼吸的通量在雨季和干季都为正值,并没有出现负值。
-
元江干热河稀树冠草丛生态系统土壤呼吸速率与5和10 cm土壤温度呈现指数相关关系,相关性显著(P<0.05)(图2)。根据式(3)计算得到的干热河谷土壤5和10 cm处土壤呼吸Q10分别为1.73和1.98。
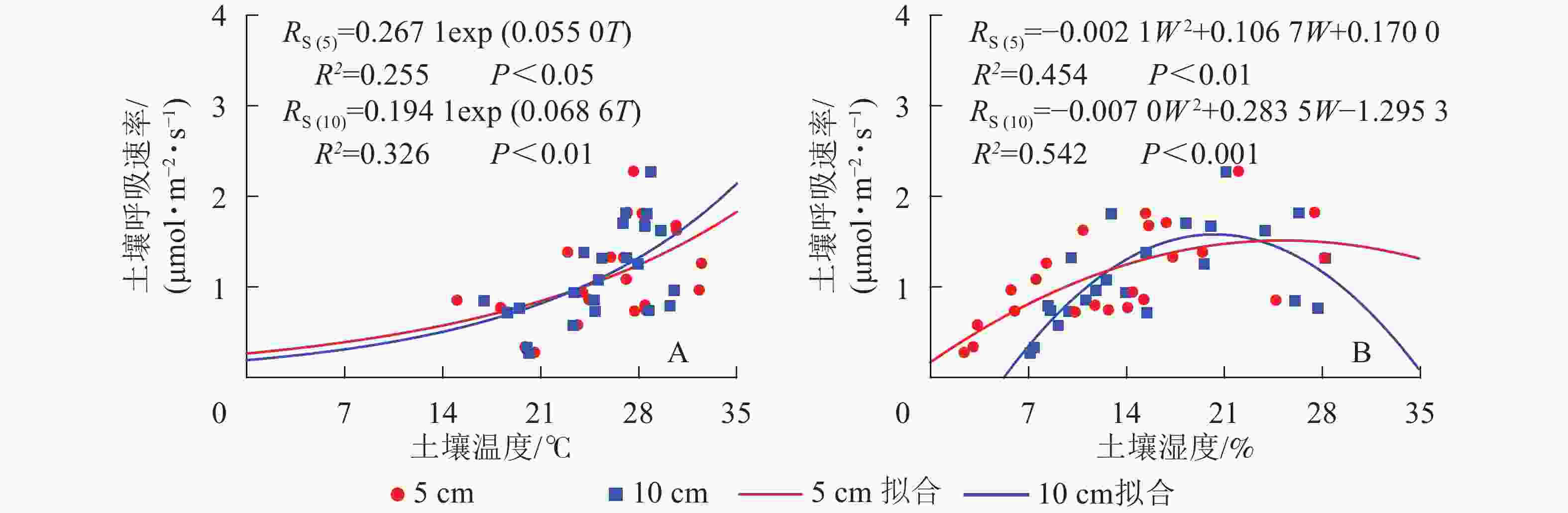
图 2 环境因子土壤温度(A)和土壤湿度(B)模拟土壤呼吸
Figure 2. Simulated results of soil respirations by environment factors soil temperature (A) and soil water content (B)
土壤呼吸速率与5和10 cm处土壤湿度呈现凸型抛物线关系,二者相关性显著(P<0.01)(图2)。湿度过低或者过高都会抑制土壤呼吸速率,其中5 cm处土壤湿度在25.4%时土壤呼吸速率最高,10 cm处土壤湿度在20.3%时土壤呼吸速率最高。
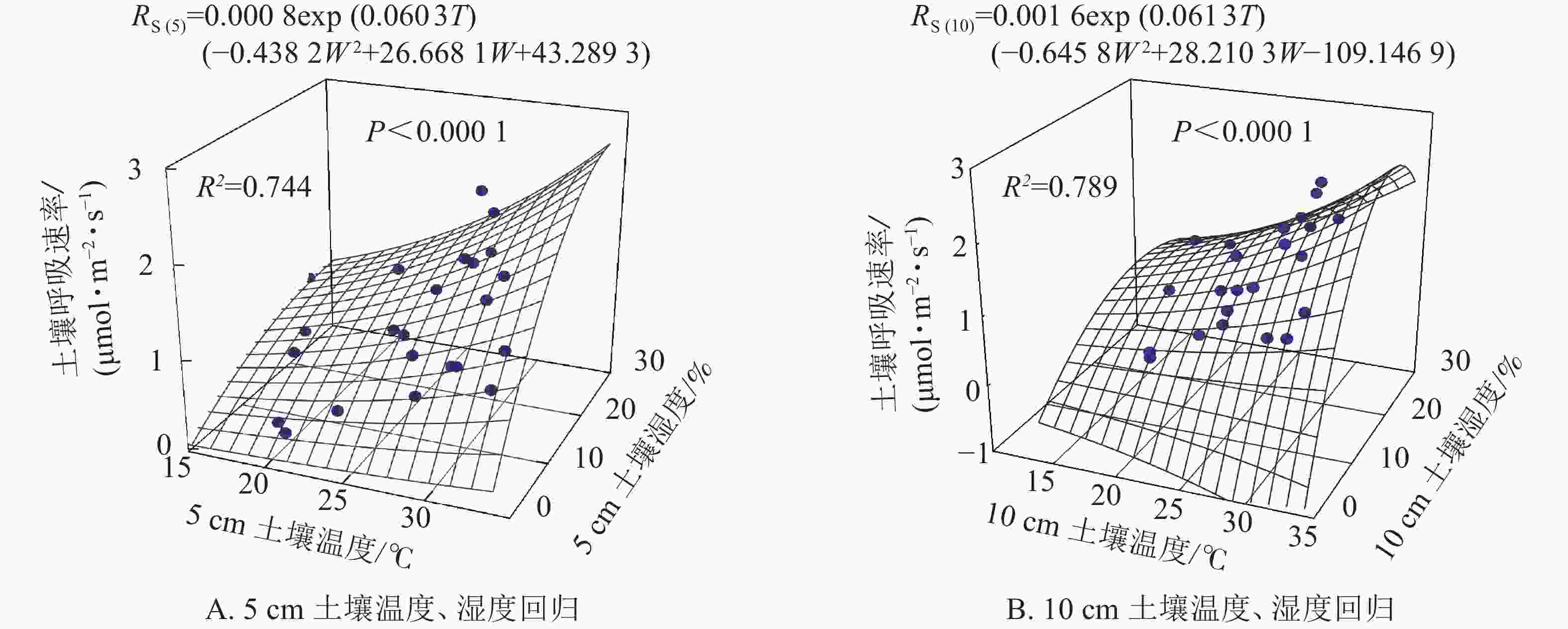
根据以上结果土壤呼吸受土壤温度和土壤湿度共同作用,因此依据式(5)拟合得图3。5和10 cm土壤温度、湿度的二因子模型可以分别解释土壤呼吸的74.4%和78.9%,拟合效果均高于土壤温度和土壤湿度单独拟合的效果(图2)。
-
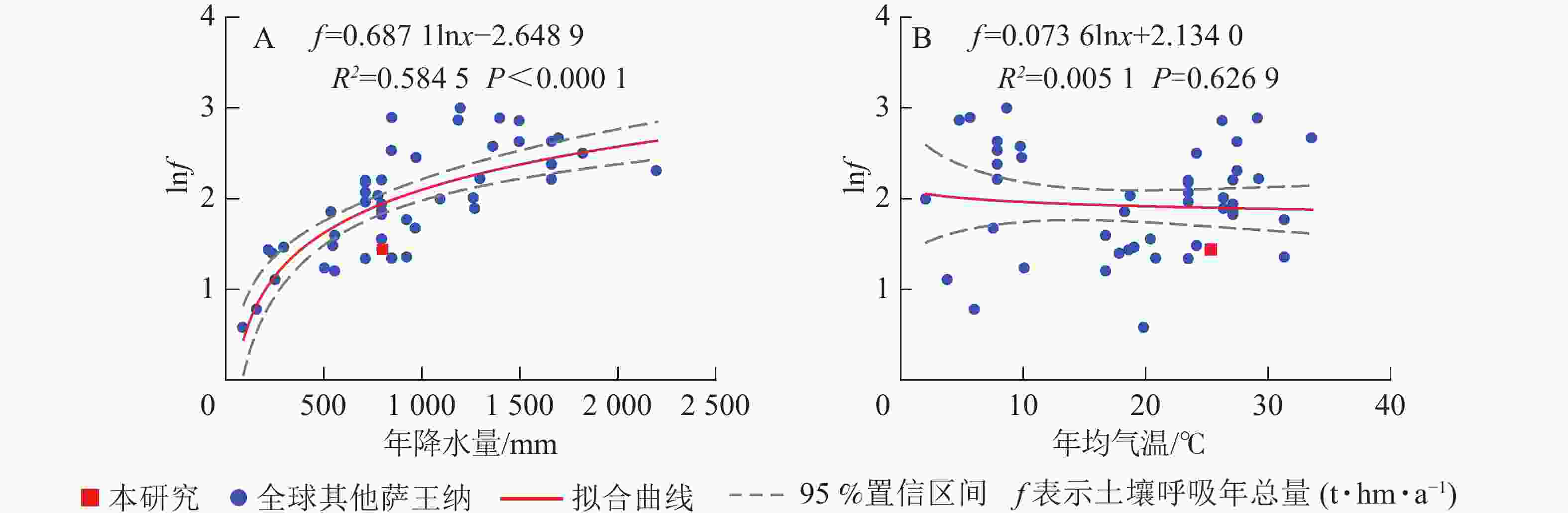
汇总全球49个点数据(图4),得出全球萨王纳生态系统土壤呼吸年总量平均值为8.16 t·hm−2·a−1,比本研究高出近1倍。本研究土壤呼吸年总量在全球萨王纳生态系统呼吸中处于较低的位置。
-
元江干热河谷稀树灌草丛生态系统干季、雨季的土壤呼吸总量分别为1.49和2.71 t·hm−2,土壤呼吸年总量为4.2 t·hm−2·a−1,低于RAICH[55]统计全球9个点得出的全球萨王纳生态系统土壤呼吸6.30 t·hm−2·a−1的均值,也低于本研究统计的全球49个点的均值,与TALMON等[31]在以色列灌丛样地,MILLARD等[18]在美国草地,REY等[32]在西班牙草地和SUN等[33]在南澳大利亚的桉树Eucalyptus spp.林的结果接近,其主要原因是这些生态系统降水量普遍偏低,而土壤呼吸总量与年均降水量相关性显著,因此这些降水量较低的萨王纳生态系统土壤呼吸均较低。
元江干热河谷稀树灌草丛生态系统土壤呼吸雨季高于旱季,这与西双版纳橡胶Hevea brasiliensis林的研究结果相似[56],在干湿季分明的地区,雨季时,温度高,降水较多,植物生长旺盛,土壤湿度较高,较多的光合产物向地下分配,并且凋落物加速分解,从而促进了土壤呼吸[57-58];干季时,温度高,降水少,土壤湿度较低,限制了土壤呼吸的进行[59-60],本研究与相关研究[61]得出温度和湿度是土壤呼吸的主要影响因子,寒冷地区温度成为土壤呼吸的主要控制因子[62],温带和亚热带则是温度和降水的季节变化交替控制土壤呼吸[63],在热带则是降水成为主要的控制因子[64]。而元江干热河谷稀树灌草丛生态系统正是干湿季分明,气温常年较高的状态,干湿季交替导致土壤湿度的显著变化,进而造成了土壤呼吸速率表现出明显的季节波动,雨季高于干季,且差异较大。
元江干热河谷稀树灌草丛生态系统干季土壤呼吸总量占年总量的35.5%,与SUN等[33]在南澳大利亚桉树林得到的结果类似,但是高于其他的已有研究结果[31, 34-35]。主要有2个原因:第一,干季土壤含水量较低,一般小于20%,土壤呼吸在土壤湿度为21%左右达到最大,因此在干季土壤湿度较低的情况下,土壤呼吸会随着土壤湿度的增加而增加,测试时间内干季降水量较50 a均值高出22%,干季降水的异常导致了较高的干季土壤呼吸;第二,本研究测定频率不高,因此可能会高估干季的土壤呼吸[17]。
-
土壤呼吸与5、10 cm处土壤温度均呈指数相关关系,这与多数研究结果一致[65-66]。然而相比于其他生态系统,干热河谷稀树灌草丛生态系统终年温度较高,且土壤湿度相对较低,对土壤呼吸产生了抑制作用,从而导致土壤呼吸和温度的指数相关较为离散,使二者趋向于凸型抛物线相关,在较干热的地区,温度较高不是限制因子,水分是主要的限制因子,导致出现这种现象[32]。土壤呼吸与土壤湿度呈凸型抛物线型关系,这与多数研究结果相似[67-68]。这表明土壤湿度过高或者过低都会抑制土壤呼吸。本研究显示:土壤呼吸的最适土壤湿度在21%左右,且最适土壤湿度5 cm大于10 cm,可能是因为雨季5 cm处土壤温度高于10 cm处土壤温度,而土壤呼吸主要受土壤温度和水分协同影响[69],本研究的结果亦是如此,因此较高的土壤温度(5、10 cm分别为27.68、28.88 ℃)需要更高的土壤湿度(5、10 cm分别为22.07%、21.12%)配合才能使土壤呼吸速率(2.27 μmol·m−1·s−1)达到最大;也可能是本研究测定频率不高,且持续时间只有1 a,因此在将来的实验中需要增加观测频率和时间长度。本研究土壤湿度与土壤呼吸速率的拟合效果优于土壤温度,土壤湿度长期处于最优土壤湿度下方,因此,该生态系统土壤呼吸可能处于抑制状态,从而使土壤湿度成为影响土壤呼吸的主要生态因子[36],这与全球萨王纳生态系统土壤呼吸速率与土壤温度拟合效果不显著与降水拟合显著的结果是一致的,表明土壤水分对全球萨王纳生态系统土壤呼吸的影响大于土壤温度。
-
由5和10 cm处土壤温度计算得到该系统土壤呼吸的Q10分别为1.73和1.98,分别小于和接近全球平均值2.0。这可能是与该生态系统全年温度较高、土壤养分含量和土壤湿度均较低有关。有关研究表明:Q10随着温度的升高而降低,随土壤有机质含量的增加而增大[70-71]。与该生态系统纬度相近而年均温较低降水较多的热带雨林的Q10为2.03~2.36[68];纬度相近年均温更低,降水更多,土壤有机质含量较高的哀牢山常绿阔叶林的Q10可达4.53[28]。因此,在年均温较高的干热河谷地区,土壤呼吸对温度的敏感性相对较低,而降水成为限制土壤呼吸的主要因子。其中5 cm处的Q10(1.73)小于10 cm处的Q10(1.98),可能是雨季5 cm处土壤温度高于10 cm处土壤温度,符合随着温度越高Q10越低的普遍认知[70-72]。10 cm土温下Q10=1.98与全球均值很接近且10 cm处土壤温度与土壤呼吸拟合效果高于5 cm土壤温度,因此在采用模型模拟元江萨王纳生态系统土壤呼吸时,建议采用10 cm处土壤温度。
-
元江干热河谷稀树灌草丛生态系统的土壤温度、湿度和土壤呼吸速率具有明显的季节变化特征,均表现为雨季高于干季。元江干热河谷稀树灌草丛生态系统土壤呼吸年总量为4.20 t·hm−2·a−1,其中,雨季的CO2排放量2.71 t·hm−2,占到全年碳排放总量的64.5%,干季的CO2排放量1.49 t·hm−2,占到全年碳排放总量的35.5%。元江干热河谷稀树灌草丛生态系统土壤呼吸速率与土壤温度和土壤湿度分别呈指数和抛物线关系,土壤呼吸受土壤温度和土壤湿度共同影响,土壤湿度是土壤呼吸的主要限制因子,5和10 cm处土壤温度计算得到的Q10分别为1.73和1.98,小于全球均值2.0。全球萨王纳生态系统年平均碳排放量为8.16 t·hm−2·a−1,比元江萨王纳生态系统高出近1倍,全球萨王纳生态系统平均降水为931.29 mm,比元江高出14.1%;全球萨王纳生态系统土壤呼吸主要受年降水量的影响。
-
感谢中国科学院西双版纳热带植物园元江干热河谷生态站和中心实验室的大力支持,以及刀万有、封乾元、刀新明在实验过程中的帮助。
Dynamic characteristics of soil respiration of Savanna ecosystem in dry hot valley of Yuanjiang
-
摘要:
目的 土壤呼吸对大气中二氧化碳浓度有重要的调节作用。萨王纳生态系统土壤呼吸是全球温室气体主要排放源之一,但是其排放特征与主要影响因子尚不清楚。 方法 以元江干热河谷(萨王纳)稀树灌草丛生态系统为对象,利用静态箱法,从2014年6月到2015年6月对元江土壤呼吸进行测量,研究了元江干热河谷稀树灌草丛生态系统土壤呼吸动态特征及其影响因子。 结果 元江干热河谷稀树灌草丛生态系统土壤温度、水分和呼吸速率具有明显的季节变化,雨季高于干季。土壤呼吸速率与土壤温度和土壤湿度分别呈指数和抛物线关系,土壤5和10 cm处温度Q10分别为1.73和1.98,小于全球均值2.0,采用10 cm土壤温度能更好地模拟土壤呼吸。通过土壤温度、湿度与土壤呼吸双因子拟合分析得出元江萨王纳生态系统的土壤呼吸主要受到水分条件的制约;生态系统土壤呼吸年排放量为4.20 t·hm−2·a−1,其中雨季2.71 t·hm−2,占全年碳排放总量的64.5 %,干季的二氧化碳排放量为1.49 t·hm−2,占全年碳排放总量的35.5 %。全球萨王纳生态系统土壤呼吸均值为8.16 t·hm−2·a−1。 结论 元江土壤呼吸总量在全球萨王纳生态系统中处于较低位置,主要是因为元江萨王纳生态系统降水量较全球萨王纳低,而降水量与萨王纳地区土壤呼吸呈极显著正相关关系(R2=0.61,P<0.001)。图4表1参72 Abstract:Objective Soil respiration plays an important role in regulating CO2 concentration in the atmosphere. Soil respiration in the Savanna ecosystem is one of the main sources of global greenhouse gas emissions, but its emission characteristics and main influencing factors are not clear. Method Taking the Savanna ecosystem in dry hot valley of Yuanjiang inYunnan Province as an example, the soil respiration was measured from June 2014 to June 2015 by static chamber method, and the dynamic characteristics and its influencing factors in the Savanna ecosystem in Yuanjiang were studied. Result Soil temperature, soil moisture and soil respiration had obvious seasonal variations, and as expected, they were significantly (P<0.01) higher in rainy season than in dry season. The relationship between soil respiration and soil temperature and soil moisture are exponential and parabola. The temperature Q10 at 5 and 10 cm of soil was 1.73 and 1.98 respectively, which was less than the global average of 2.0. Therefore, using 10 cm soil temperature could better simulate soil respiration. Fitting analysis of soil temperature, water content and soil respiration showed that the soil respiration of Savanna ecosystem in Yuanjiang was mainly restricted by water condition. The annual emission of soil respiration in the ecosystem was 4.20 t·hm−2·a−1, including 2.71 t·hm−2 in rainy season, accounting for 64.5% of the total annual carbon emission, and 1.49 t·hm−2 in dry season, accounting for 35.5% of the total annual carbon emission. The average value of soil respiration in global Savanna ecosystem is 8.16 t·hm−2·a−1. Conclusion Compared with the global Savanna ecosystem, the total amount of soil respiration in Yuanjiang was in a lower position, which could be attributed to the lower rainfall in the Savanna ecosystem in Yuanjiang. There exists a significant positive correlation between rainfall and soil respiration in the Savanna region (R2=0.61, P<0.001). [Ch, 4 fig. 1 tab. 72 ref.] -
Key words:
- soil respiration /
- Q10 /
- Savanna /
- soil temperature /
- soil moisture
-
表 1 干季、雨季和全年降水、土壤呼吸总量和土壤温度、湿度日均值
Table 1. Total value of precipitation and soil respiration, daily mean values soil temperature, soil water content in the dry season, the rain season and annual respectively
时期 土壤温度/℃ 土壤湿度/% 土壤呼吸总量/(t·hm−2) 降水/mm 5 cm 10 cm 5 cm 10 cm 干季 22.0±1.2 B 22.4±0.5 B 12.5±0.9 B 13.8±1.2 B 1.49±0.53 B 203.1 雨季 29.0±1.1 A 27.8±0.4 A 14.7±1.1 A 17.8±1.0 A 2.71±0.76 A 515.2 年 25.7±1.2 25.2±0.4 13.7±1.0 15.9±1.1 4.20±1.30 718.3 说明:数值为平均值±标准误,同列不同大写字母表示同一指标不同时期在0.01水平差异显著 -
[1] SCHLESINGER W H, ANDREWS J A. Soil respiration and the global carbon cycle [J]. Biogeochemistry, 2000, 48(1): 7 − 20. [2] CROWTHER T W, VAN DEN HOOGEN J, WAN J, et al. The global soil community and its influence on biogeochemistry[J]. Science, 2019, 365(6455): 722. doi: 10.1126/science.aav0550. [3] HASHIMOTO S. A new estimation of global soil greenhouse gas fluxes using a simple data-oriented model[J]. Plos One, 2012, 7(8): E41962. doi: 10.1371/journal.pone.0041962. [4] BOND-LAMBERTY B, THOMSON A. Temperature-associated increases in the global soil respiration record [J]. Nature, 2010, 464(7288): 579 − 582. [5] SPONSELLER R A. Precipitation pulses and soil CO2 flux in a Sonoran Desert Ecosystem [J]. Glob Change Biol, 2007, 13(2): 426 − 436. [6] BAE K, FAHEY T J, YANAI R D, et al. Soil nitrogen availability affects belowground carbon allocation and soil respiration in northern hardwood forests of new hampshire [J]. Ecosystems, 2015, 18(7): 1179 − 1191. [7] BUTLE A, MEIR P, SAIZ G, et al. Annual variation in soil respiration and its component parts in two structurally contrasting woody Savannas in central Brazil [J]. Plant Soil, 2012, 352(1): 129 − 142. [8] JANSSENS I, DIELEMAN W, LUYSSAERT S, et al. Reduction of forest soil respiration in response to nitrogen deposition [J]. Nat Geosci, 2010, 3(5): 315 − 322. [9] MOYANO F E, LUYSSAERT N, et al. The moisture response of soil heterotrophic respiration: interaction with soil properties [J]. Biogeosciences, 2012, 9(3): 1173 − 1182. [10] FANG C, MONCRIEFF J B. The dependence of soil CO2 efflux on temperature [J]. Soil Biol Biochem, 2001, 33(2): 155 − 165. [11] LIU Xiaozhong, WAN Shiqiang, SU Bo, et al. Response of soil CO2 efflux to water manipulation in a tallgrass prairie ecosystem [J]. Plant Soil, 2002, 240(2): 213 − 223. [12] QI Ye, XU Ming, WU Jianguo. Temperature sensitivity of soil respiration and its effects on ecosystem carbon budget: nonlinearity begets surprises [J]. Ecol Modelling, 2002, 153(1/2): 131 − 142. [13] WANG Yuesi, HU Yuqiong, JI Baoming, et al. An investigation on the relationship between emission uptake of greenhouse gases and environmental factors in semiarid grassland [J]. Adv Atmos Sci, 2003, 20(1): 119 − 127. [14] GRACE J, JOS J S, MEIR P, et al. Productivity and carbon fluxes of tropical Savannas [J]. J Biogeogr, 2006, 33(3): 387 − 400. [15] PEEL M C, FINLAYSON B L, MCMAHON T A. Updated world map of the köppen-geiger climate classification [J]. Hydrol Earth Syst Sci Discuss, 2007, 4(2): 439 − 473. [16] BOUSQUET P, CIAIS P, MILLER J, et al. Contribution of anthropogenic and natural sources to atmospheric methane variability [J]. Nature, 2006, 443(7110): 439 − 443. [17] LIVESLEY S J, GROVER S, HUTLEY L B, et al. Seasonal variation and fire effects on CH4, N2O and CO2 exchange in savanna soils of northern australia [J]. Agric For Meteorol, 2011, 151(11): 1440 − 1452. [18] MILLARD P, MIDWOOD A J, HUNT J E, et al. Partitioning soil surface CO2 efflux into autotrophic and heterotrophic components using natural gradients in soil Δ13C in an undisturbed Savannah soil [J]. Soil Biol Biochem, 2008, 40(7): 1575 − 1582. [19] 何永彬, 卢培泽, 朱彤. 横断山——云南高原干热河谷形成原因研究[J]. 资源科学, 2000, 22(5): 69 − 72. HE Yongbin, LU Peize, ZHU Tong. Causes for formation of dry-hot valleys in Hengduan mountain-Yunnan plateau [J]. Resour Sci, 2000, 22(5): 69 − 72. [20] 金振洲. 云南元江干热河谷半萨王纳植被的植物群落学研究[J]. 广西植物, 1999, 19(4): 289 − 302. JIN Zhenzhou. A phytosociological study on the semi-savanna vegetation in the dry-hot valleys of Yuanjiang River, Yunnan [J]. Guihaia, 1999, 19(4): 289 − 302. [21] 刘方炎, 李昆. 萨王纳群落研究进展[J]. 世界林业研究, 2008, 21(6): 25 − 30. LIU Fangyan, LI Kun. Research advances in Savanna community [J]. World For Res, 2008, 21(6): 25 − 30. [22] 张一平, 段泽新, 窦军霞. 岷江上游干暖河谷与元江干热河谷的气候特征比较研究[J]. 长江流域资源与环境, 2005, 14(1): 76 − 82. ZHANG Yiping, DUAN Zexin, DOU Junxia. Comparison of climate characteristics between a dry-warm valley in upper reaches of Min River and a dry-hot valley of Yuanjiang River [J]. Resour Environ Yang Basin, 2005, 14(1): 76 − 82. [23] 沈蕊, 张建利, 何彪, 等. 元江流域干热河谷草地植物群落结构特征与相似性分析[J]. 生态环境学报, 2010, 19(12): 2821 − 2825. SHEN Rui, ZHANG Jianli, HE Biao, et al. The structure characteristic and analysis on similarity of grassland community in dry-hot valley of Yuanjiang River [J]. Ecol Environ Sci, 2010, 19(12): 2821 − 2825. [24] 张树斌, 张教林, 曹坤芳. 季节性干旱对白皮乌口树(Tarenna depauperata Hutchins)水分状况、叶片光谱特征和荧光参数的影响[J]. 植物科学学报, 2016, 34(1): 117 − 126. ZHANG Shubin, ZHANG Jiaolin, CAO Kunfang. Effects of seasonal drought on water status, leaf spectral traits and pluoescence parameters in Tarenna depauperata Hutchins, a Chinese savanna evergreen species [J]. Plant Sci J, 2016, 34(1): 117 − 126. [25] ZHOU Wenjun, JI Hongli, ZHU Jing, et al. The effects of nitrogen fertilization on N2O emissions from a rubber plantation [J]. Sci Rep, 2016, 6: 28230. [26] 竹万宽, 陈少雄, ARNOLD R, 等. 不同种桉树人工林土壤呼吸速率时空动态及其影响要素[J]. 浙江农林大学学报, 2018, 35(3): 412 − 421. ZHU Wankuan, CHEN Shaoxiong, ARNOLD R, et al. Temproal and spatial dynamics of soil respiration and influencing factors in eucalyptus plantations [J]. J Zhejiang A&F Univ, 2018, 35(3): 412 − 421. [27] 徐睿, 姜春前, 白彦锋, 等. 杉木纯林和混交林土壤温室气体通量的差异[J]. 浙江农林大学学报, 2019, 36(2): 307 − 317. XU Rui, JIANG Chunqian, BAI Yanfeng, et al. Soli greenhouse gas fluxes in pure and mixed stands of Chinese fir[J]. J Zhejiang A&F Univ, 2019, 36(2): 307 − 317. [28] 冯文婷, 邹晓明, 沙丽清, 等. 哀牢山中山湿性常绿阔叶林土壤呼吸季节和昼夜变化特征及影响因子比较[J]. 植物生态学报, 2008, 32(1): 31 − 39. FENG Wenting, ZOU Xiaoming, SHA Liqing, et al. Comparisons between seasonal and diurnal patterns of soil respiration in a montane evergreen broad-leaved forest of Ailaomoutains, China [J]. Chin J Plant Ecol, 2008, 32(1): 31 − 39. [29] ZHANG Xiang, ZHANG Yiping, SHA Liqing, et al. Effects of continuous drought stress on soil respiration in a tropical rain forest in southwest China [J]. Plant Soil, 2015, 394(1/2): 343 − 353. [30] JIANG H, DENG Q, ZHOU G, et al. Responses of soil respiration and its temperature moisture sensitivity to precipitation in three subtropical forests in southern China [J]. Biogeosciences, 2013, 10(6): 3963 − 3982. [31] TALMON Y, STERNBERG M, GRÜNZWEI J M. Impact of rainfall manipulations and biotic controls on soil respiration in Mediterranean and desert ecosystems along an aridity gradient [J]. Glob Change Biol, 2011, 17(2): 1108 − 1118. [32] REY A, PEGORARO E, OYONARTE C, et al. Impact of land degradation on soil respiration in a steppe (Stipa tenacissima L.) semi-arid ecosystem in the SE of Spain [J]. Soil Biol Biochem, 2011, 43(2): 393 − 403. [33] SUN Q Q, MEYER W S, KOERBER G R, et al. A wildfire event influences ecosystem carbon fluxes but not soil respiration in a semi-arid woodland [J]. Agric For Meteorol, 2016, 226/227: 57 − 66. [34] RICHARDS A E, DATHE J F, COOK G D. Fire interacts with season to influence soil respiration in tropical Savannas [J]. Soil Biol Biochem, 2012, 53: 90 − 98. [35] LIU Tao, XU Zhenzhu, HOU Yanhui, et al. Effects of warming and changing precipitation rates on soil respiration over two years in a desert steppe of northern China [J]. Plant Soil, 2016, 400(1/2): 15 − 27. [36] HOLT J A, HODGEN M J, LAMB D. Soil respiration in the seasonally dry tropics near townsville, North Queensland [J]. Soil Biol Biochem, 1990, 28(5): 737 − 745. [37] GUPTA S R, SINGH J S. Soil respiration in a tropical grassland [J]. Soil Biol Biochem, 1981, 13(4): 261 − 268. [38] UPADHYAYA S D, SIDDIQUI S A, SINGH V P. Seasonal variation in soil respiration of certain tropical grassland communities [J]. Trop Ecol, 1981, 22: 157 − 161. [39] BRIDGE B J, MOTT J J, HARTIGAN R J. The formation of degraded areas in the dry Savanna woodlands of northern Australia [J]. Aust J Soil Res, 1983, 21(1): 91 − 104. [40] SANHUEZA E, SANTANA M. CO2 emissions from tropical Savanna soil under first year of cultivation [J]. Interciencia, 1994, 19: 20 − 23. [41] PINTO A D S, BUSTAMANTE M M C, KISSELLE K, et al. Soil emissions of N2O, NO, and CO2 in Brazilian Savannas: Effects of vegetation type, seasonality, and prescribed fires [J]. J Geophys Res, 2002, 107(D20): 8089. [42] CHEN Xiaosong, HUTLEY L B, EAMUS D. Carbon balance of a tropical Savanna of northern Australia [J]. Oecologia, 2003, 137(3): 405 − 416. [43] XU Liukang, BALDOCCHI D D, TANG Jianwu. How soil moisture, rain pulses, and growth alter the response of ecosystem respiration to temperature [J]. Global Biologychem Cycles, 2004, 18(4): GB4002. [44] HIBBARD K A, LAW B E, REICHSTEIN M, et al. An analysis of soil respiration across northern hemisphere temperate ecosystems [J]. Biogeochemistry, 2005, 73(1): 29 − 70. [45] TANG J, BALDOCCHI D D. Spatial-temporal variation in soil respiration in an oak-grass Savanna ecosystem in california and its partitioning into autotrophic and heterotrophic components [J]. Biogeochemistry, 2005, 73(1): 183 − 207. [46] MCCULLEY R L, BOUTTON T W, ARCHER S R. Soil respiration in a subtropical Savanna parkland: response to water additions [J]. Soil Sci Soc Am J, 2007, 71(3): 820 − 828. [47] YUSTE J C, BALDOCCHI D D, GERSHENSON A, et al. Microbial soil respiration and its dependency on carbon inputs, soil temperature and moisture [J]. Glob Chang Biol, 2007, 13(9): 2018 − 2035. [48] BAHN M, RODEGHIERO M, ANDERSON-DUNN M, et al. Soil respiration in European grasslands in relation to climate and assimilate supply [J]. Ecosystems, 2008, 11(8): 1352 − 1367. [49] NOUVELLON Y, EPRON D, KINANA A, et al. Soil CO2 effluxes soil carbon balance and early tree growth following Savanna a afforestation in congo comparison of two site preparation treatments [J]. For Ecol Manage, 2008, 255(5): 1926 − 1936. [50] VARGAS R, ALLEN M F. Environmental controls and the influence of vegetation 1 type, fine roots and rhizomorphs on diel and seasonal variation in soil respiration [J]. New Phytol, 2008, 179(2): 460 − 471. [51] BRÜMMER C, PAPEN H, WASSMANN R, et al. Fluxes of CH4 and CO2 from soil and termite mounds in south Sudanian savanna of Burkina Faso (west Africa)[J]. Glob Biologychem Cycles, 2009, 23(1): GB1001. doi: 10.1029/2008GB003237. [52] MAJOR J, LEHMANN J, RONDON M, et al. Fate of soil-applied black carbon: downward migration, leaching and soil respiration [J]. Glob Chang Biol, 2010, 16(4): 1366 − 1379. [53] NOUVELLON Y, EPRON D, MARSDEN C, et al. Age-related changes in litter inputs explain annual trends in soil CO2 effluxes over a full Eucalyptus rotation after afforestation of a tropical Savanna [J]. Biogeochemistry, 2012, 111(1/3): 515 − 533. [54] FAN Z S, NEFF J C, HANAN N P. Modeling pulsed soil respiration in an African Savanna ecosystem [J]. Agric For Meteorol, 2015, 200: 282 − 292. [55] RAICH J W. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate [J]. Tellus, 1992, 44(2): 81 − 99. [56] GAO Jinbo, ZHANG Yiping, SONG Qinghai, et al. Stand age-related effects on soil respiration in rubber plantations (Hevea brasiliensis) in Southwest China [J]. Eur J Soil Sci, 2019, 70(6): 1 − 13. [57] 吴玉, 郑新军, 李彦, 等. 荒漠草本植物在不同降雨模式下的光合响应和生物量分配策略[J]. 生态学杂志, 2013, 32(10): 2583 − 2590. WU Yu, ZHENG Xinjun, LI Yan, et al. Photosynthetic responses and biomass allocation strategies of desert herbaceous plants under different precipitation patterns [J]. Chin J Ecol, 2013, 32(10): 2583 − 2590. [58] 马志良, 高顺, 杨万勤, 等. 亚热带常绿阔叶林区凋落叶木质素和纤维素在不同雨热季节的降解特征[J]. 生态学杂志, 2015, 34(1): 122 − 129. MA Zhiliang, GAO Shun, YANG Wanqin, et al. Degradation characteristics of lignin and cellulose of foliar litter at different rainy stages in subtropical evergreen broadleaved forest [J]. Chin J Ecol, 2015, 34(1): 122 − 129. [59] 刘殿君, 吴波, 李永华, 等. 极端干旱区增雨对泡泡刺(Nitraria sphaerocarpa)群落土壤呼吸的影响[J]. 中国沙漠, 2013, 33(3): 788 − 796. LIU Dianjun, WU Bo, LI Yonghua, et al. Effect of rain supplementation on soil respiration of Nitraria sphaerocarpa community in hyperarid area of Dunhuang, China [J]. J Desert Res, 2013, 33(3): 788 − 796. [60] 王义东, 王辉民, 马泽清, 等. 土壤呼吸对降雨响应的研究进展[J]. 植物生态学报, 2010, 34(5): 601 − 610. WANG Yidong, WANG Huimin, MA Zeqing, et al. Review of response mechanism of soil respiration to rainfall [J]. Chin J Plant Ecol, 2010, 34(5): 601 − 610. [61] DAVIDSON E A, BELK E, BOONE R D. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest [J]. Global Change Biol, 1998, 4(2): 217 − 227. [62] 周非飞, 林波, 刘庆. 青藏高原东缘亚高山针叶林人工恢复过程中的土壤呼吸特征[J]. 应用生态学报, 2009, 20(8): 1783 − 1790. ZHOU Feifei, LIN Bo, LIU Qin. Characteristics of soil respiration in artificial restoration process of subalpine coniferous for est in eastern Qinghai-Tibet Plateau [J]. Chin J Appl Ecol, 2009, 20(8): 1783 − 1790. [63] 常建国, 刘世荣, 史作民, 等. 北亚热带-南暖温带过渡区典型森林生态系统土壤呼吸及其组分分离[J]. 生态学报, 2007, 27(5): 1791 − 1802. CHANG Jianguo, LIU Shirong, SHI Zuomin, et al. Soil respiration and its components partitioning in the typical for estecosystems at the transitional area from the northern subtropics to warm temperate, China [J]. Acta Ecol Sin, 2007, 27(5): 1791 − 1802. [64] HASHIMOTO S, TANAKA N, SUZUKI M, et al. Soil respiration and soil CO2 concentration in a tropical forest Thailand [J]. J For Res, 2004, 9(1): 75 − 79. [65] 刘博奇, 牟长城, 邢亚娟, 等. 小兴安岭典型温带森林土壤呼吸对强降雨的响应[J]. 北京林业大学学报, 2016, 38(4): 77 − 85. LIU Boqi, MOU Changcheng, XING Yajuan, et al. Effect of strong rainfalls on soil respiration in a typical temperate forest in Lesser Xing’an Mountains, northeast China [J]. J Beijing For Univ, 2016, 38(4): 77 − 85. [66] NIE Cheng, LI Yue, NIU Lei, et al. Soil respiration and its Q10 response to various grazing systems of a typical steppe in Inner Mongolia, China[J]. PeerJ, 2019, 7: e7112. doi: 10.7717/peerJ.7112. [67] DAVIDSON E A, VERCHOT L V, CATT NIO J H, et al. Effects of soil Water content on soil respiration in forests and cattle pastures of eastern Amazonia [J]. Biogeochemistry, 2000, 48(1): 53 − 69. [68] 沙丽清, 郑征, 唐建维, 等. 西双版纳热带季节雨林的土壤呼吸研究[J]. 中国科学: 地球科学, 2004, 34(增刊 2): 167 − 174. SHA Liqing, ZHENG Zheng, TANG Jianwei, et al. Soil respiration of tropical seasonal rain forest in Xishuangbanna [J]. Sci China Ser D Earth Sci, 2004, 34(suppl 2): 167 − 174. [69] 李凌浩, 王其兵, 白永飞, 等. 锡林河流域羊草草原群落土壤呼吸及其影响因子的研究[J]. 植物生态学报, 2000, 24(6): 680 − 686. LI Linghao, WANG Qibing, BAI Yongfei, et al. Soil respiration of a Leymus chinensis grassland stand in the Xilin River basin as affected by over-grazing and climate [J]. Acta Phytoecol Sin, 2000, 24(6): 680 − 686. [70] KIM Y, NISHINA K, CHAE N, et al. Constraint of soil moisture on CO2 efflux from tundra lichen moss and tussock in council Alaska using a Hierarchical Bayesian Model [J]. Biogeosciences, 2014, 11(19): 5567 − 5579. [71] WANG X, PIAO S, CIAIS P, et al. Are ecological gradients in seasonal Q10 of soil respiration explained by climate or by vegetation seasonality [J]. Soil Biol Biochem, 2010, 42(10): 1728 − 1734. [72] 刘运通, 张一平, 武传胜, 等. 模拟亚热带常绿阔叶林土壤温度与土壤异养呼吸对气候变暖的响应[J]. 生态学杂志, 2016, 35(7): 1799 − 1806. LIU Yuntong, ZHANG Yiping, WU Chuansheng, et al. Simulation of the responses of soil temperature and soil heterotrophic respiration to climate warming in a subtropical evergreen broad-leaved forest [J]. Chin J Ecol, 2016, 35(7): 1799 − 1806. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20190647






 下载:
下载: