-
吲哚乙酸是一种重要的植物激素,在植物叶片形成、根系生长发育、叶片脱落等一系列植物生命活动中起着重要作用[1]。除植物自身合成的少量吲哚乙酸外,根际微生物也是植物获取吲哚乙酸的重要来源之一,微生物以植物根际分泌物为营养物质合成并分泌吲哚乙酸等植物激素[2]。目前常见的吲哚乙酸产生菌有芽孢杆菌Bacillus sp.、普罗维登斯菌Providencia sp.、假单胞菌Pseudomonas sp.等,这类微生物常存在于根际土壤和植物体内[3]。它们在进行生理活动的过程中能够分泌吲哚乙酸,提高土壤或植物中吲哚乙酸含量,促进植物生长;同时部分吲哚乙酸产生菌能够分泌抗菌肽类物质,帮助植物抵御病原微生物的入侵[4]。因此,筛选并合理利用吲哚乙酸产生菌能够促进作物生长,是实现农业可持续发展的有效方法。
目前,研究者们主要从植物根际或农田土壤等环境中获取吲哚乙酸产生菌,如CHANDRA等[5]从甜菊Stevia rebaudiana根际筛选到1株吲哚乙酸产生菌并进行了发酵条件优化,该菌株的吲哚乙酸产量最高可达104 mg·L−1;CHAIHARN等[6]从水稻Oryza sativa根际分离得到了1株吲哚乙酸产生菌并与有机肥配施提升了作物产量;SHOKRI等[7]从农田土壤中获取吲哚乙酸产生菌并验证了它们之间存在的协同作用可以提高吲哚乙酸的产量。蚯蚓堆肥是目前公认的优质有机肥料[8],拥有丰富的微生物种群和多种植物激素。蔡琳琳等[9]研究表明:蚯蚓堆肥可以提高土壤肥力并刺激植物生长。由蚯蚓堆肥中分离出高产的吲哚乙酸产生菌并进行优化,可以进一步提升蚯蚓堆肥的应用价值,并且利用蚯蚓堆肥及吲哚乙酸产生菌制备微生物肥料时,筛选的微生物具备更高的适应性。然而,目前鲜有从蚯蚓堆肥中分离吲哚乙酸产生菌的报道,因此从蚯蚓堆肥中筛选吲哚乙酸产生菌对利用蚯蚓堆肥制备微生物肥料具有重要意义。
本研究以蚯蚓堆肥中的微生物为研究对象,通过Salkowski显色法、高效液相色谱法筛选吲哚乙酸高产菌株并鉴定其菌属。分析供试菌株的吲哚乙酸代谢通路,深入探究其最适发酵参数,获取较高的吲哚乙酸产量,为合理利用该菌株及蚯蚓堆肥提供理论依据。
-
蚯蚓堆肥采自浙江省杭州市临安区研口村餐厨垃圾处理基地(30.24°N,119.83°E),储存在无菌密封袋中置于4 ℃冰箱备用。
-
Luria-Bertani(LB)液体培养基:酵母提取物(C15H31N3O13P2) 5.0 g·L−1,氯化钠(NaCl) 10.0 g·L−1,胰蛋白胨(C18H16O5) 10.0 g·L−1,pH 7.0 ± 0.2,121 ℃高压灭菌30 min。
LB固体培养基:酵母提取物5.0 g·L−1,氯化钠 10.0 g·L−1,胰蛋白胨 10.0 g·L−1,琼脂粉(C14H24O9) 15.0 g·L−1,pH 7.0 ± 0.2,121 ℃高压灭菌30 min。
Salkowski试剂:500.0 mL 质量分数为35%的高氯酸(HClO4),10.0 mL 0.5 mol·L−1 氯化铁(FeCl3),混合摇匀。
-
取10.0 g 蚯蚓堆肥添加到100.0 mL无菌水中,搅拌30 min后静置10 min,取上层清液用无菌水稀释至10−3~10−7梯度浓度。取各稀释液100.0 μL分别涂布于LB固体培养基,30 ℃培养24 h。随后挑选形态不同的单菌落在LB固体培养基上划线纯化。将纯化的单菌落分别接种至LB液体培养基,30 ℃、120 r·min−1培养24 h。取不同菌株的菌悬液各10.0 mL在10 000 r·min−1离心15 min,各取2.0 mL上清液加入等体积Salkowski试剂混匀,避光处静置20 min进行显色,混合液变为粉红色说明菌株具备吲哚乙酸生产能力[10]。取变为粉红色的菌悬液与无菌甘油按1∶1(体积比)混合后储存于−80 ℃冰箱备用。
-
以LB液体培养基为溶剂分别配置5、10、50、100、200、1 000 mg·L−1的吲哚乙酸标准品溶液,取标准品溶液各5.0 mL,加入等体积乙酸乙酯混匀后静置1 h,上层溶液移入干净离心管,下层溶液中再加入等体积乙酸乙酯,混匀后静置1 h,再次将上层溶液移入同一离心管。上述过程重复3次。将上层萃取液在氮气流中吹干,用1.0 mL色谱纯甲醇溶解残留在试管中的固体物质,溶液通过0.45 μm有机相滤膜后,通过高效液相色谱仪(Agilent
1220 Infinity Ⅱ)测定并制作标准曲线。液相色谱条件为甲醇∶超纯水(体积分数为0.1%的乙酸)= 60∶40,进样量10.0 μL,流速1.0 mL·min−1,柱温35 ℃,紫外吸收波长279 nm,Poroshell 120 EC-C18 (4.6 mm × 150 mm, 4 μm)色谱柱。重复3次。 -
取菌悬液各2.0 mL接种于100.0 mL LB液体培养基,30 ℃、120 r·min−1培养24 h,取10.0 mL培养液10 000 r·min−1离心15 min,取5.0 mL上清液按照上述标准溶液处理方法进行预处理后,使用高效液相色谱仪分析测定吲哚乙酸质量浓度。每个处理重复3次。
-
采用16S rRNA双向(通用引物27F/1492R)聚合酶链式反应(PCR)扩增和测序分析鉴定菌株。将获得的16S rRNA测序结果与美国国家生物技术信息中心(NCBI)数据库中具有高亲缘关系的菌株序列进行比对,并采用Neighbor-Joining方法构建各菌株的系统发育进化树,分析鉴定菌株种属[11]。
-
取10.0 mL目标菌株培养液10 000 r·min−1离心15 min,取上清液储存于−80 ℃冰箱过夜备用,采用液质联用仪(LC-MS, LC: Shimadzu LC-30A, MS: SCIEX Triple TOF 6600+)分析上清液中的物质组成。液质联用参数为超纯水(体积分数为0.1%的甲酸)∶乙腈(体积分数为0.1%的甲酸)= 10∶90,进样量2.0 μL,流速0.40 mL·min−1,柱温40 ℃,Water ACQUITY UPLC BEH C18 (2.1 mm × 100 mm, 1.8 μm)色谱柱。通过液质数据分析上清液中的物质组成推断菌株的吲哚乙酸合成途径。
-
通过单因素实验,以每次优化后的最优变量为前提,依次对下述发酵条件进行优化:发酵时间(6、12、24、30、36、48 h)、接种量(1%、2%、3%、4%、5%, 体积比)、氯化钠质量浓度(5.0、10.0、20.0、30.0、40.0、50.0 g·L−1)、初始pH (4、5、6、7、8、9)、L-色氨酸质量浓度(0.5、1.0、1.5、2.0、2.5、3.0、3.5 g·L−1)以培养及温度(15、20、25、30、35、40、45、50 ℃)。分别通过高效液相色谱仪及紫外分光光度计测定目标菌株的吲哚乙酸产量和菌浓度[600 nm处吸光度D(600)],获得最佳的菌株发酵参数。每个处理重复3次。
-
取适量小白菜Brassica rapa var. chinensis种子晒种6 h,用清水筛选健康且饱满的种子,用体积分数为1% 次氯酸钠(NaClO)溶液消毒20 min,使用无菌水冲洗干净,于避光处静置泡种24 h。
将目标菌株按照最佳发酵参数进行培养。取菌株发酵液15.0 mL,5 000 r·min−1离心15 min,分离菌株和发酵上清液,使用体积分数为0.85%的生理盐水洗净菌株后重悬于15.0 mL无菌水中。将滤纸裁剪至合适大小并平铺于培养皿底部,分别加入4.0 mL菌悬液、发酵上清液、无菌水及LB液体培养基。每个处理均匀布置20颗小白菜种子并置于30 ℃避光处静置,设置3组重复。隔24 h记录种子萌发情况并补充适量溶液以保持滤纸湿润。所有操作均在无菌条件下进行。
-
用Excel 2017统计数据;用SPSS 22.0进行显著性分析;用Origin 2024和MEGA 11绘制图表并构建系统发育进化树。
-
从蚯蚓堆肥中共分离出6株与Salkowski试剂发生显著显色反应的菌株,表明它们具有较强吲哚乙酸生产能力(图1)。菌株vm12和vm29的吲哚乙酸产量相对较高,分别为41.27和39.99 mg·L−1,高于TSAVKELOVA等[12]筛选的根瘤菌Rhizobium sp. (4.50 mg·L−1)和鞘氨醇单胞菌Sphingomonas sp. (10.10 mg·L−1)的产量。
-
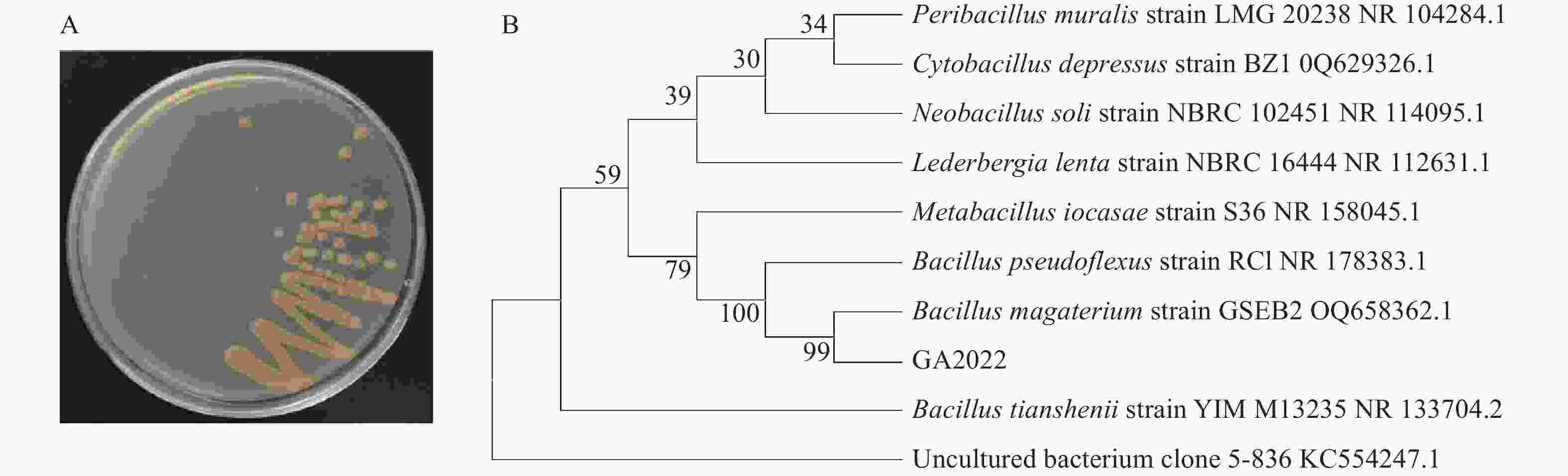
NCBI数据库比对结果显示:vm12和vm29分别与克雷伯氏菌属Klebsiella sp.和芽孢杆菌属具有较高的同源性。克雷伯氏菌是一类寄生于人和动物的呼吸道及肠道的致病菌[13−14],而芽孢杆菌大多无致病性,广泛地应用于工农业及医药生产[15−16]。因此,本研究选择vm29作为供试菌株,并命名为GA2022。形态学分析表明:菌株GA2022的菌落个体较大,近似圆形且个体差异显著,菌落边缘不规则并有隆起和褶皱,呈黄色(图2A)。菌株GA2022的系统发育树如图2B所示。
-
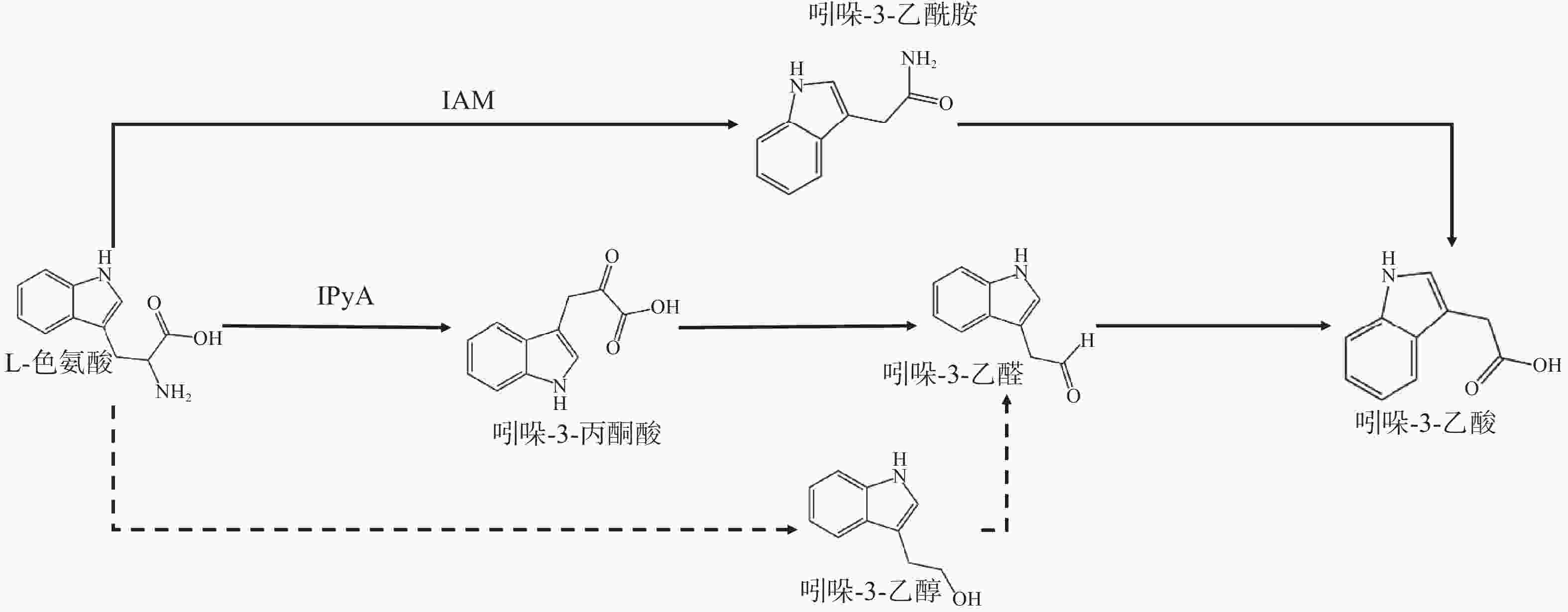
液质联用仪分析表明:菌株GA2022的培养液中存在L-色氨酸、吲哚-3-乙酰胺、吲哚-3-丙酮酸、吲哚-3-乙醛、吲哚-3-乙醇以及吲哚乙酸。据此推测,菌株GA2022可能同时存在3条吲哚乙酸合成途径(图3)。第1条途径是吲哚-3-乙酰胺途径(IAM途径)。L-色氨酸由aux1/iaaM基因编码的色氨酸单加氧酶转化为吲哚-3-乙酰胺后,被aux2/iaaH编码的吲哚乙酰胺水解酶转化为吲哚乙酸。细菌能否通过IAM途径合成吲哚乙酸主要取决于该细菌是否拥有编码色氨酸单加氧酶和吲哚乙酰胺水解酶的基因iaaM和iaaH [17]。IAM途径同时存在于微生物和植物体内。第2条途径是吲哚-3-丙酮酸途径(IPyA途径)。L-色氨酸在氨基转移酶(AT)的作用下脱去氨基转化为吲哚-3-丙酮酸,再被脱羧酶(IPDC)转化为吲哚-3-乙醛,吲哚-3-乙醛被醛脱氢酶(IAO)氧化为吲哚乙酸[18]。该路径在植物和细菌中广泛存在,编码醛脱氢酶的基因是IPyA途径的关键基因,该途径广泛存在于植物和细菌体内。第3条途径是L-色氨酸受酶催化脱羧、脱氨、水解得到吲哚-3-乙醇,吲哚-3-乙醇中的醇羟基经酶氧化后得到吲哚-3-乙醛,再经醛脱氢酶将氧化为吲哚乙酸。该路径与IPyA途径具有共同的中间产物吲哚-3-乙醛,并已在荧光假单胞菌Pseudomonas fluorescens、羽扇豆根瘤菌Rhizobium lupini中发现,但该途径的基因转录机制尚不完全清楚[19]。
-
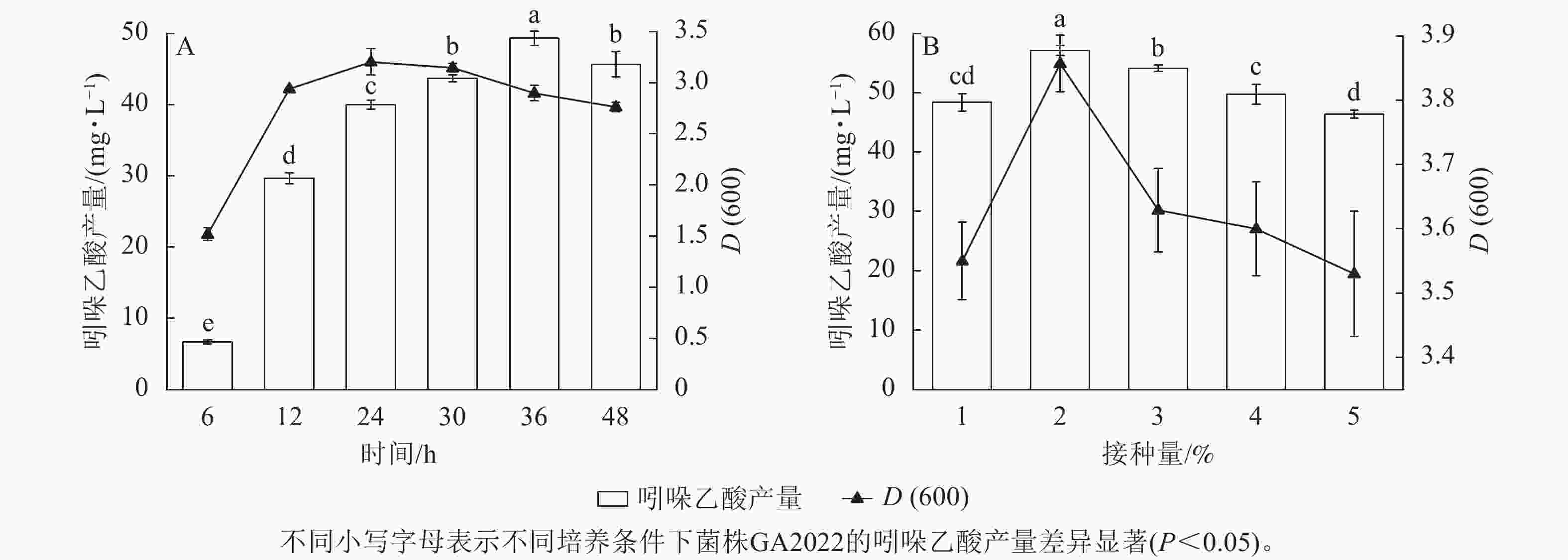
吲哚乙酸产量和菌浓度[D(600)]均随时间先上升后下降,吲哚乙酸产量在培养时间为36 h时达最大值(49.32 mg·L−1),显著高于其他处理,D(600)于24 h时达最大值(3.20,图4A)。吲哚乙酸产量和D(600)在培养初期快速上升,可能是因为初期培养基内养分及生长空间充足,细胞得以快速增殖和代谢。随着培养时间延长,培养基内生存空间和营养物质快速消耗,种内竞争不断加剧,限制了菌株GA2022的生长速率和代谢强度[20]。随着养分逐渐耗尽,菌株GA2022进入生长衰退期,吲哚乙酸的合成速率逐渐低于分解速率,造成吲哚乙酸产量在培养后期显著下降(P<0.05)。由于吲哚乙酸产量在36 h时达到峰值,菌株GA2022的最适培养时间为36 h。
-
随着接种量上升,吲哚乙酸产量和D(600)均先上升后下降,两者均在接种量为2%(体积比)时达到峰值,分别为57.12 mg·L−1和3.86,显著高于其他接种量(图4B)。接种量偏低时吲哚乙酸产量和D(600)均较低,可能是因为较低的初始细胞数量限制了细胞增殖速率(P<0.05),延缓了吲哚乙酸的积累。此外,接种量偏高时吲哚乙酸产量和D(600)同样较低,这可能是由于较高的初始细胞数量加剧了种内竞争,加速了有毒代谢产物(如酸性物质)的累积,从而限制了细胞增殖和吲哚乙酸合成[21]。因此,菌株GA2022的最适接种量为2%。
-
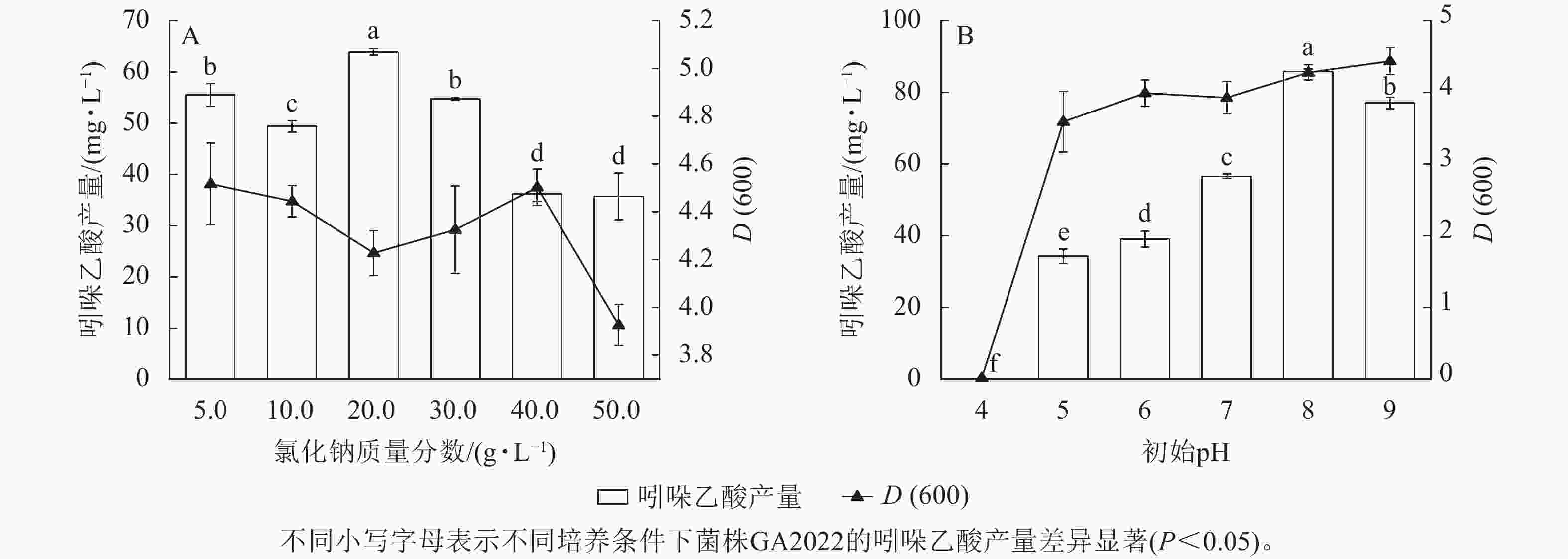
氯化钠质量浓度对吲哚乙酸产量和D(600)的影响无线性规律。氯化钠质量浓度为20.0 g·L−1时,吲哚乙酸产量达到峰值(63.92 mg·L−1),这可能是因为菌株GA2022在盐胁迫环境下通过合成吲哚乙酸来调节自身生理功能[22−23]。氯化钠质量浓度为5 g·L−1时,D(600)达到峰值(4.52,图5A)。因此,菌株GA2022的最适氯化钠质量浓度为20.0 g·L−1,该质量浓度下菌株GA2022的吲哚乙酸产量显著高于其他处理(P<0.05)。
-
吲哚乙酸产量和D(600)均随pH增加呈上升趋势,初始pH为8时,吲哚乙酸产量达到峰值(85.77 mg·L−1),显著高于其他处理组(P<0.05),初始pH为9时,D(600)达到峰值(4.44),初始pH偏低时吲哚乙酸产量和D(600)均较低(图5B),这可能与调节细胞生命周期的酶和参与吲哚乙酸合成代谢的酶的最适pH有关[24]。D(600)在碱性环境下相对较高,这可能是因为弱碱性环境有利于维持细胞壁的稳定性和通透性,促进了细胞对营养物质的吸收和利用[25]。由于吲哚乙酸产量在初始pH为8时达到峰值,所以菌株GA2022的最适初始pH为8。
-
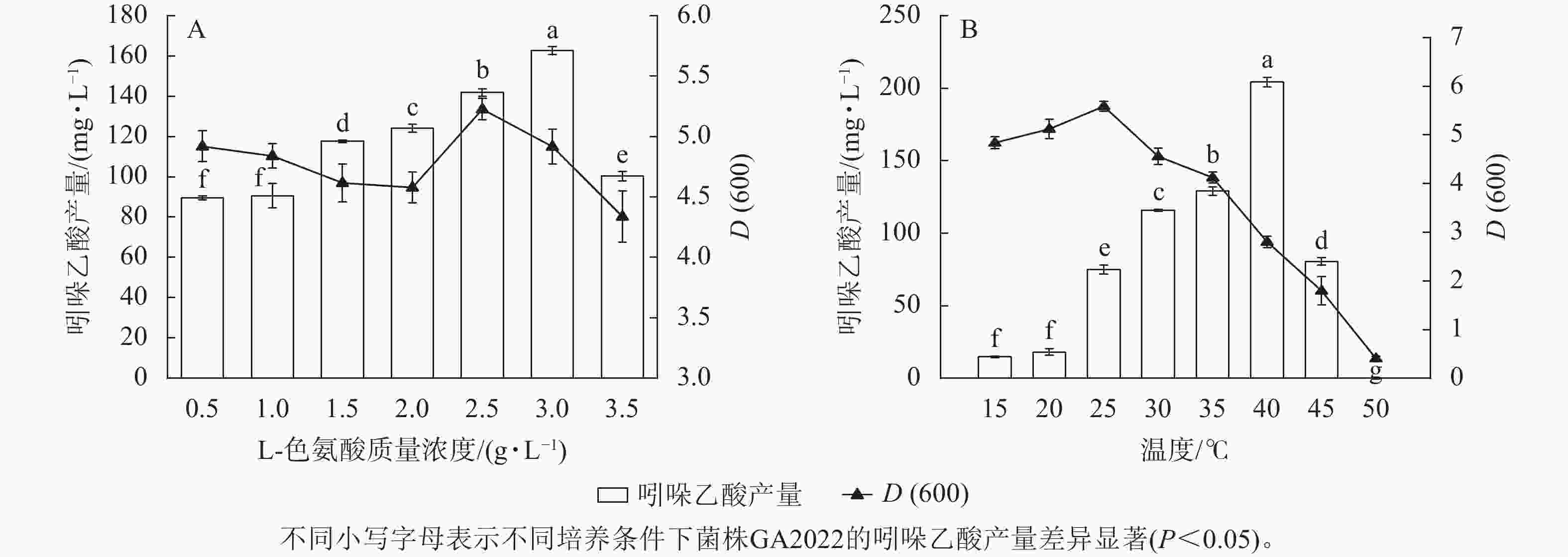
L-色氨酸质量浓度与吲哚乙酸产量大致呈线性正相关,但与D(600)无线性规律。L-色氨酸质量浓度为3.0 g·L−1时,吲哚乙酸产量达到峰值(162.57 mg·L−1),L-色氨酸质量浓度2.5 g·L−1时,D(600)达到峰值(5.2,图6A)。可能因为L-色氨酸是吲哚乙酸的合成底物,提升底物质量浓度有利于产物的合成,但底物质量浓度过高加剧了环境中的盐胁迫,造成L-色氨酸质量浓度为3.5 g·L−1时,吲哚乙酸产量显著下降[26](图6A)。由于吲哚乙酸产量在L-色氨酸质量浓度为3.0 g·L−1时达到峰值,所以菌株GA2022的最适L-色氨酸质量浓度为3.0 g·L−1。
-
吲哚乙酸产量和D(600)均随培养温度升高先上升后下降,40 ℃时吲哚乙酸产量达到峰值(204.25 mg·L−1)。25 ℃时D(600)达到峰值(5.59,图6B)。吲哚乙酸产量达到峰值时培养温度较高,可能是因为参与吲哚乙酸合成的关键酶如色氨酸侧链氧化酶(TMO)、氨基转移酶等在高温下活性较强,促进了吲哚乙酸的生产[27]。吲哚乙酸产量达到峰值时的培养温度和D(600)达到峰值时的培养温度并不一致,可能是因为主导吲哚乙酸合成的酶系和主导细胞增殖的酶系对培养温度的适应性不同。由于吲哚乙酸产量在40 ℃时达到峰值,所以菌株GA2022的最适培养温度为40 ℃。
-
表1对比了不同来源的吲哚乙酸产生菌在最适条件下的吲哚乙酸产量。由表1可见:源自蚯蚓堆肥的菌株GA2022的吲哚乙酸产量高于其他常见来源的菌株(根际土壤等)。菌株GA2022培养36 h后获得最大吲哚乙酸产量,优于菌株TPK5b2的72 h和FP6的96 h,这可能与菌株GA2022同时存在3条吲哚乙酸代谢通路有关。同枯草芽孢杆菌Bacillus subtilis A7相比,菌株GA2022具有较好的耐高温及耐盐碱性能。菌株A7在高于25 ℃的温度下,吲哚乙酸产量仅为20 mg·L−1,而菌株GA2022在45 ℃时仍能保持产量在75 mg·L−1以上;此外菌株A7仅在pH为7时展示出较好的吲哚乙酸生产能力,菌株GA2022在中性和弱碱条件下均具备较好的吲哚乙酸生产能力。
-
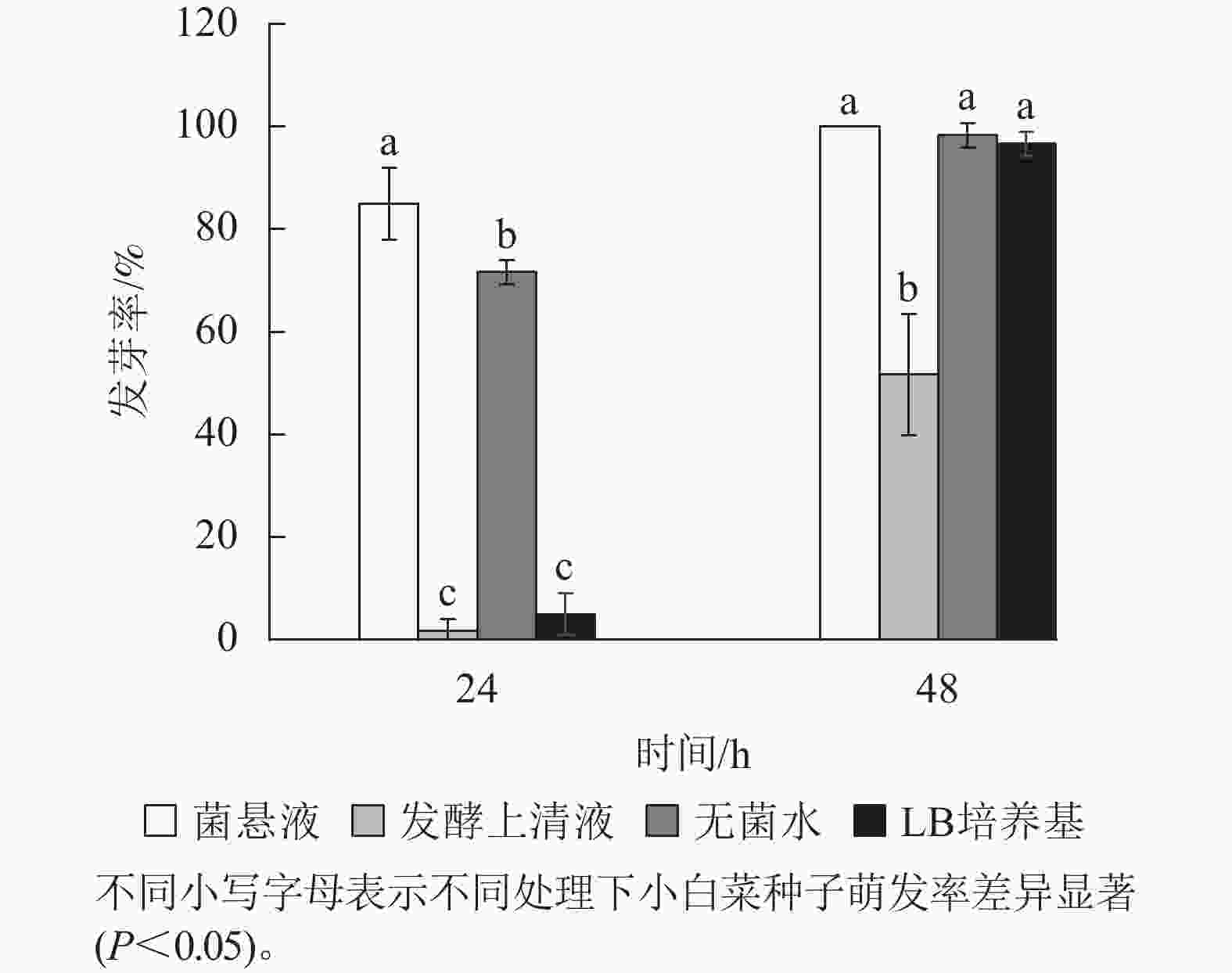
菌悬液处理组的小白菜种子,24 h发芽率为85.00%,显著高于其他3组(P<0.05,图7)。这表明菌株GA2022可能产生了促进小白菜种子萌发的生物活性物质,如吲哚乙酸等植物生长激素或其他有益代谢物;发酵上清液处理组的小白菜种子,48 h发芽率仅为51.67%,显著低于其他3组(P<0.05,图7)。结果表明:菌株GA2022对小白菜种子萌发具有显著促进作用,但其发酵上清液会抑制种子萌发,可能是因为菌株代谢产生的有害物质积累(如酚类化合物、挥发性脂肪酸等)或过高的吲哚乙酸质量浓度[31]。
-
本研究筛选到1株源自蚯蚓堆肥的吲哚乙酸高产芽孢杆菌GA2022,该菌株在最适发酵条件下的吲哚乙酸产量可达204.25 mg·L−1;该菌株同时具备吲哚-3-乙酰胺途径、吲哚-3-丙酮酸途径以及吲哚乙醇途径3种吲哚乙酸合成途径,对小白菜种子的萌发具有显著促进作用。该菌株的吲哚乙酸产量显著高于其他源自根际土壤等常规环境菌的吲哚乙酸产量。该菌株扩充了菌肥用微生物的种质资源,在培养时间36 h、接种量2%(体积比)、氯化钠质量浓度为20.0 g·L−1、初始pH为8、L-色氨酸质量浓度为3.0 g·L−1、培养温度为40 ℃条件下显示出最佳的吲哚乙酸生产能力,吲哚乙酸产量较优化前提升410.75%。
Screening, metabolic pathway analysis and fermentation condition optimization of a high-yielding strain of indoleacetic acid from earthworm compost
doi: 10.11833/j.issn.2095-0756.20240426
- Received Date: 2024-07-04
- Accepted Date: 2024-12-03
- Rev Recd Date: 2024-11-27
- Available Online: 2025-05-30
- Publish Date: 2025-05-30
-
Key words:
- earthworm compost /
- indoleacetic acid /
- high performance liquid chromatography /
- Bacillus
Abstract:
| Citation: | GUO Changjian, YU Kefei, ZHENG Zhanwang. Screening, metabolic pathway analysis and fermentation condition optimization of a high-yielding strain of indoleacetic acid from earthworm compost[J]. Journal of Zhejiang A&F University, 2025, 42(3): 477−485 doi: 10.11833/j.issn.2095-0756.20240426 |











 DownLoad:
DownLoad:





