-
果实大小是评判果实品质的重要性状之一,也是决定果实分级的重要参数,对刺激消费者购买欲至关重要[1]。近年来,一些研究采用疏花疏果[2]、环剥[3−4]、施用外源激素[2, 5]等农艺措施控制柑橘属Citrus果实大小。此外,一些基因作用于细胞分裂和细胞膨大,影响果实大小[6−10]。其中,番茄Solanum lycopersicum SlFW2.2是第1个被分离出来的与果实大小相关的数量性状基因,其表达水平与细胞分裂呈负相关,对番茄果实质量变异约有30%的贡献率[11−12]。SlFW2.2属于PLAC8超基因家族,含有PLAC8结构域,该结构域是由一段富含半胱氨酸的序列组成[13−14]。FW2.2同源基因在玉米Zea mays、水稻Oryza sativa、梨Pyrus bretschneideri等植物中存在,并且都含有PLAC8结构域,在器官大小调控、镉金属积累等方面发挥功能[15]。目前,已对梨[14]、牛油果Persea americana [16]、樱桃Prunus avium[17]和枇杷Eriobotrya japonica[18]等的FW2.2同源基因进行了研究,其功能均与细胞分裂相关,并影响果实大小。
柑橘C. reticulata是重要的果树之一。2023年中国的柑橘种植面积超过300万hm2,产量超过6 433万t。果实大小是柑橘果实分级和果园经济效益的主要决定因素。近年来,人们日益重视对柑橘果实大小相关基因的挖掘和功能研究,并获得了与柑橘果实大小指数相关的数量性状遗传位点(quantitative trait loci,QTLs),如与单果横径、质量相关的QTLs[19−21],但未鉴定到控制果实大小的功能基因。FW2.2家族为研究柑橘果实大小的分子机制提供了良好的候选基因。然而,柑橘中尚未有FW2.2基因家族全基因组鉴定的报道。
甜橙C. sinensis是深受消费者喜爱的柑橘栽培种之一。本研究对甜橙FW2.2家族基因进行全基因组鉴定,分析其基因结构、染色体定位和顺式作用元件等理化性质,研究FW2.2家族成员在甜橙果实细胞分裂期的表达情况,为进一步探究FW2.2家族基因在甜橙果实发育中的功能提供参考,并为柑橘果实大小调控提供基因支持。
-
选取3株冠幅、株高、树龄较为一致,植株生长状况良好且无病虫害的甜橙‘锦红’C. sinensis ‘Jinhong’。2023年在树冠中上部采集开花前7和3 d的花苞(花后−7、−3 d),完全盛开的花苞(花后0 d),开花后7、30和40 d (花后7、30和40 d)的幼果,剥离出花苞中的子房,同幼果一起用液氮速冻后放于−80 ℃超低温冰箱保存,用于实时荧光定量聚合酶链式反应(RT-qPCR)分析。将子房和幼果用FAA固定液固定,用于石蜡切片制备。
-
将花后−7、−3、0、7、30和40 d的子房和幼果放入FAA固定液中固定24 h,再经过脱水、透明、渗蜡、包埋等处理后切片。切片用甲苯胺蓝染色后用中性树脂封片,风干后,于显微镜(Nikon Eclipse E100)下观察并拍照。随机选取10个大小均匀的视野,使用Image J软件统计细胞大小。细胞层数代表细胞数量,参考HAMADA等[22]的方法进行统计。
-
从华中农业大学柑橘基因组数据库下载甜橙V3.0基因组数据。在美国国家生物信息技术中心(NCBI)网站获得番茄FW2.2蛋白序列,作为query序列检索甜橙FW2.2家族成员;在Pfam数据库获得FW2.2家族的隐马尔可夫模型(Pfam: PF04749),利用HMM在甜橙基因组数据库检索FW2.2成员。将2种方法获得的甜橙FW2.2家族基因整合后,利用NCBI-CDD剔除不含有PLAC8结构域的基因,即可得到甜橙FW2.2家族基因,将各成员依次命名为CsFWL1~CsFWL16。
利用Plant-mPLoc 对甜橙FWLs蛋白亚细胞分布位置进行预测。利用TBtools预测氨基酸数、分子量(单位为kDa)、等电点和亲水系数等理化性质。
利用ClustalW对甜橙、番茄[17, 23]、玉米[24]、水稻[25]、梨[26]和桃Prunus persica [17]中FW2.2基因序列进行多序列比对分析,通过MEGA 7.0,采用邻接法(neighbor-joining,NJ),设置参数Bootstrap method为1 000,其他参数默认,生成进化树。利用iTOL软件修饰进化树。
-
以甜橙基因组数据为基础,利用TBtools进行染色体定位分析。将氨基酸序列上传到在线网站GSDS和MEME进行基因结构和保守基序分析,并利用TBtools进行可视化分析。
-
采用TBtools的Fasta Extract工具提取甜橙FW2.2家族基因起始密码子上游2 000 bp的启动子区域序列,将启动子序列提交到PlantCare 进行顺式作用元件分析,并利用TBtools的Heatmap工具进行可视化。
-
用多糖多酚总RNA提取试剂盒(中国天根)提取果实的总RNA。通过NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge,苏州近岸蛋白)合成cDNA。采用NovoStart® SYBR qPCR SuperMix Plus (苏州近岸蛋白)在RT-qPCR仪上检测CsFWLs的基因表达。CsActin为内参基因。采用2−ΔΔCT计算基因的相关表达量。引物信息见表1。
表 1 RT-qPCR引物序列
Table 1. Primer sequence of RT-qPCR
基因 正向引物序列 反向引物序列 CsFWL1 ACTGCTTCTCCGACTGCTCAAC GCAGCCTGTCAGCCAAGCTATT CsFWL2 ACTGCCTCCTCTCATGCGTG TCTAGATGGGTCGAGTCCCC CsFWL3 CCAACACAACCACAAGCA GTCGTCACAGCAATCACA CsFWL4 AAATCACTGCCTGCCTTACTCT TCTTCCACGCAACTTCCACAAC CsFWL5 AAGAGAAGGCGGGTGGTGAAGAG AGGCGGATTGGAGAGCGATGGG CsFWL6 CTTGCTTATACTCGTGCGGCTATC TTTCTCCAAATTTCCATGCCATCC CsFWL7 ACTGCGTCCCTCACTTCT GGTTCCTGTTCCTCGTTC CsFWL8 TTCCTATCCAAAAATGGGGTT AATCACTTCACACTGGCTCACA CsFWL9 CCGCTACCGGAAAGCTACGAG AAGTGCCAATCCACCTTCAATAC CsFWL10 GCTGTTGTTGGTGTACTCTTGCT CGTGGCAAAGGTGACAACTGAT CsFWL11 GGTGACTGGCTGCGGGTGCTTAT ACATGTCGAATCCACGGGCTTTG CsFWL12 GCTTGGTTCATTGCTGTTGCT GAGTCTCTTTCTCTACATTCCC CsFWL13 TTGCGGCGACACTATTCATT CCAACCTATGGAGGGATTAACA CsFWL14 AGCAAGTTCAACCTCCCCGAAG AATAGAAGGATCCCAGCCTCTG CsFWL15 ATGTGGAAAAGATGAGAGAA ACCAAGCAAAAAACAAACCC CsFWL16 AAACTTTTAACATTCAGGGCGG GGCTTCATATATTGGTACGGCG -
采用Excel 2021进行数据处理,通过GraphPadPrism 8进行单因素方差分析(one-way ANOVA)和制图。
-
甜橙FW2.2家族包含16个成员。甜橙FW2.2家族成员的氨基酸数量为100~563个,分子量为11.69~63.60 kDa,等电点为4.78~9.06,亲水系数为−0.564~0.132;CsFWL5的不稳定系数为38.54,其余成员的不稳定指数均大于40.00;CsFWL7、CsFWL8、CsFWL12、CsFWL14和CsFWL16定位在细胞膜和细胞核,其他FW2.2家族成员定位在细胞膜(表2)。
表 2 甜橙FW2.2家族基因的基本信息
Table 2. Detailed information of identified FW2.2 genes in C. sinensis
基因名称 基因ID 氨基酸数/个 分子量/kD 等电点 不稳定系数 亲水系数 亚细胞定位 CsFWL1 Cs_ont_2g013230 156 17.29 5.30 53.89 −0.066 细胞膜 CsFWL2 Cs_ont_9g009130 139 15.34 8.28 44.43 0.083 细胞膜 CsFWL3 Cs_ont_7g019620 136 14.60 5.11 60.76 0.132 细胞膜 CsFWL4 Cs_ont_6g019810 253 27.20 5.34 57.84 −0.328 细胞膜 CsFWL5 Cs_ont_2g006240 251 28.26 5.20 38.54 −0.112 细胞膜 CsFWL6 Cs_ont_2g013260 176 19.36 7.02 45.13 −0.151 细胞膜 CsFWL7 Cs_ont_5g036960 100 11.69 8.86 46.13 −0.503 细胞膜、细胞核 CsFWL8 Cs_ont_1g028600 419 48.20 7.09 51.40 −0.503 细胞膜、细胞核 CsFWL9 Cs_ont_5g001070 240 26.38 4.78 49.87 −0.163 细胞膜 CsFWL10 Cs_ont_7g002410 563 63.60 9.06 49.82 −0.190 细胞膜 CsFWL11 Cs_ont_2g013300 176 19.27 6.62 40.79 −0.069 细胞膜 CsFWL12 Cs_ont_2g013320 184 20.75 8.27 44.87 −0.179 细胞膜、细胞核 CsFWL13 Cs_ont_7g019640 149 16.65 6.39 58.53 −0.195 细胞膜 CsFWL14 Cs_ont_5g036990 315 34.55 5.42 57.59 −0.564 细胞膜、细胞核 CsFWL15 Cs_ont_9g023590 236 26.27 4.90 46.47 −0.353 细胞膜 CsFWL16 Cs_ont_7g001970 393 44.39 5.80 40.20 −0.268 细胞膜、细胞核 -
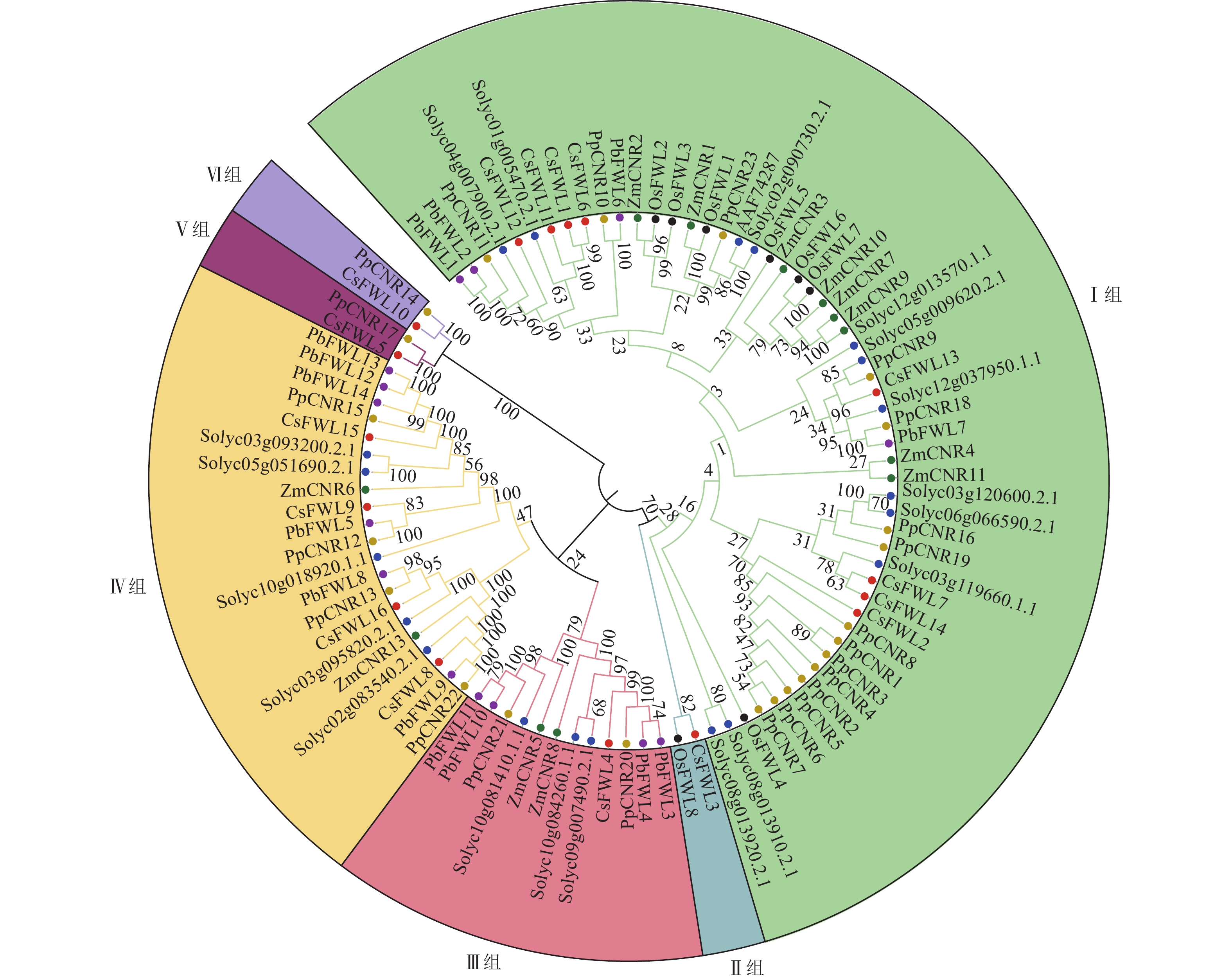
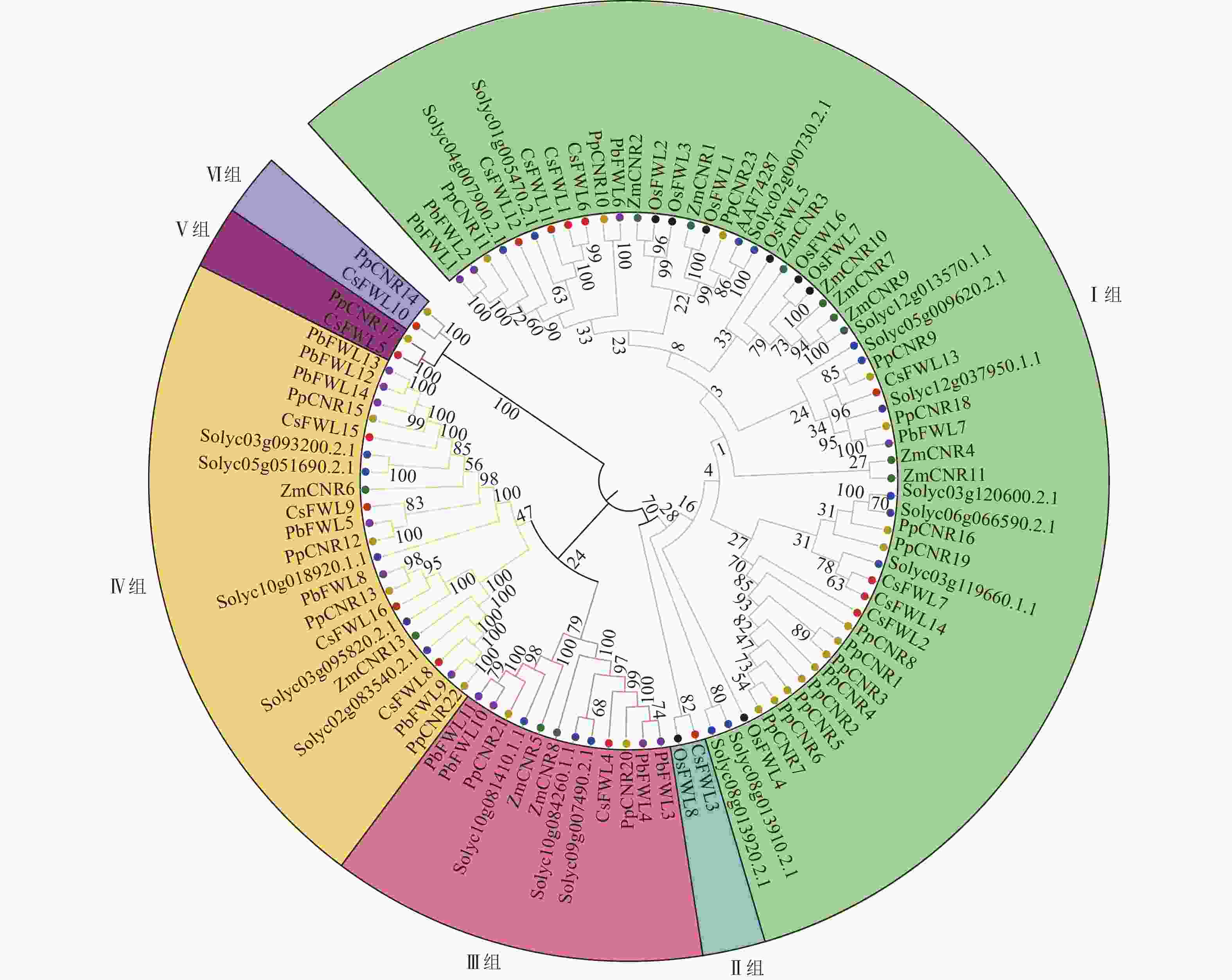
为鉴定甜橙CsFW2.2与其他物种FW2.2家族的进化关系,对甜橙中16个FW2.2蛋白、12个玉米ZmFW2.2、20个番茄SlFW2.2、23个桃PpFW2.2、14个梨PbFW2.2和8个水稻OsFW2.2进行蛋白序列比对,并构建发育进化树(图1)。由图1可知:所有FW2.2蛋白分为6组。Ⅰ组是最大的1个分支,包括CsFWL1、CsFWL2、CsFWL6、CsFWL7、CsFWL11、CsFWL12、CsFWL13和CsFWL14等8个甜橙FWLs蛋白,OsFWL1~OsFWL7等7个水稻FWLs蛋白,PpCNR1~PpCNR8、PpCNR10、PpCNR11等15个桃CNRs蛋白,Solyc04g007900等11个番茄FWLs蛋白,ZmCNR1~ZmCNR4和ZmCNR7、ZmCNR9、ZmCNR10等7个玉米CNRs蛋白及PbFWL1、PbFWL2等4个梨FWLs蛋白。Ⅱ组只包括OsFWL8和CsFWL3。Ⅲ组包括CsFWL4,PbCNR3、PbCNR4、PbCNR10等4个梨FWLs蛋白,PpCNR20和PpCNR21等2个桃CNRs蛋白,以及Solyc10g081410等3个番茄FWLs蛋白。Ⅳ组是第二大分支,包括4个CsFWLs蛋白(CsFWL8、CsFWL9、CsFWL15、CsFWL16),4个PpCNRs蛋白(PpCNR12、PpCNR13、PpCNR15和PpCNR22),5个番茄FWLs蛋白,6个PbFWLs蛋白和2个ZmCNRs蛋白;Ⅴ组包括CsFWL5和PpCNR17。Ⅵ组包含CsFWL10和PpCNR14。系统进化树分析结果显示:大多数物种的FWLs蛋白,如番茄、桃、玉米和梨聚在一支,说明它们在进化过程中的保守性和同源性较高。另外,CsFWL5、CsFWL10和CsFWL3分别与桃PpCNR17、PpCNR14,玉米OsFWL8聚在一支,表明进化上这3个CsFWLs蛋白与桃或玉米的同源性较高,功能上可能更相似。这一发现为探索FW2.2基因家族的功能分化和进化提供了新的方向。
-
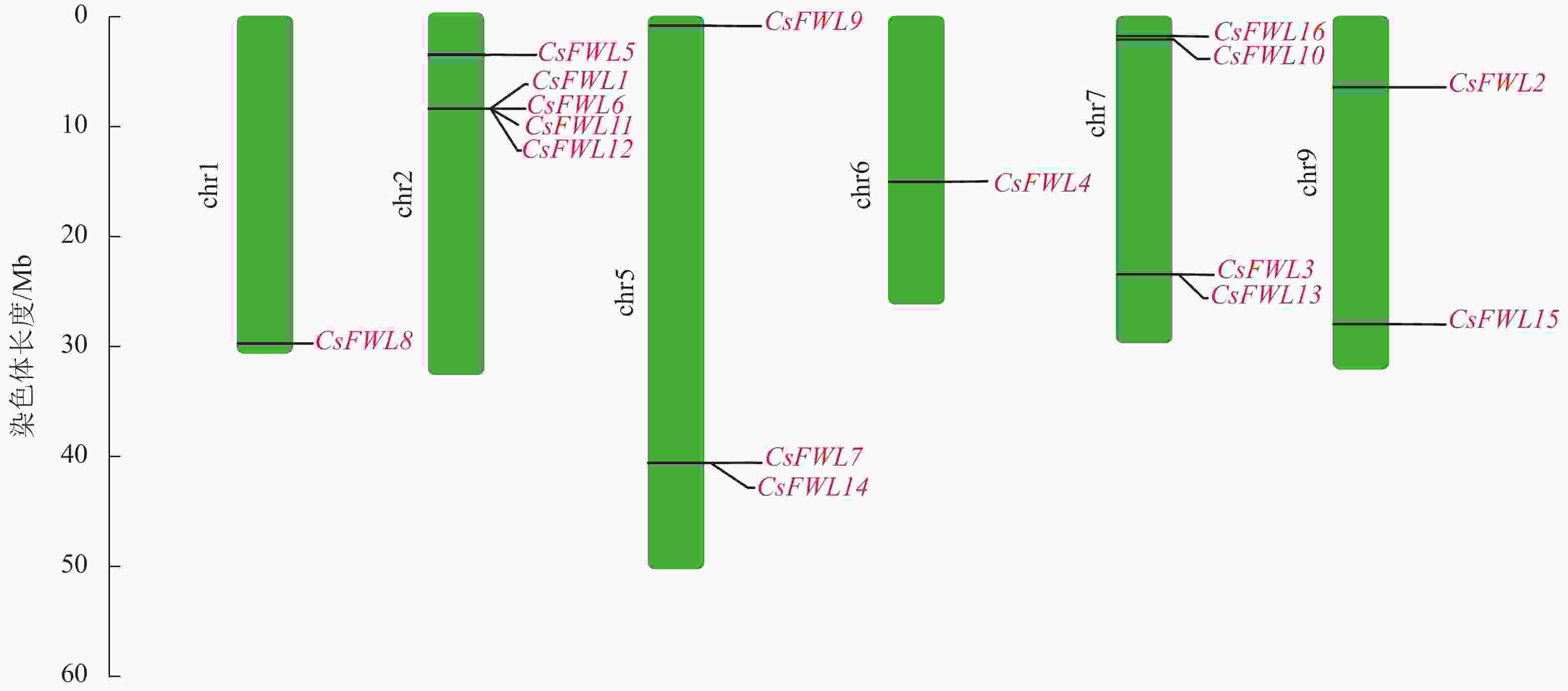
染色体定位结果显示:甜橙FW2.2家族16个成员分布在6条染色体上。其中CsFWL8分布在1号染色体上,CsFWL1、CsFWL5、CsFWL6、CsFWL11和CsFWL12分布在2号染色体上,CsFWL7、CsFWL9和CsFWL14分布在5号染色体上,CsFWL4分布在6号染色体上,CsFWL3、CsFWL13、CsFWL10和CsFWL16分布在7号染色体上,CsFWL2和CsFWL15分布在9号染色体上(图2)。
-
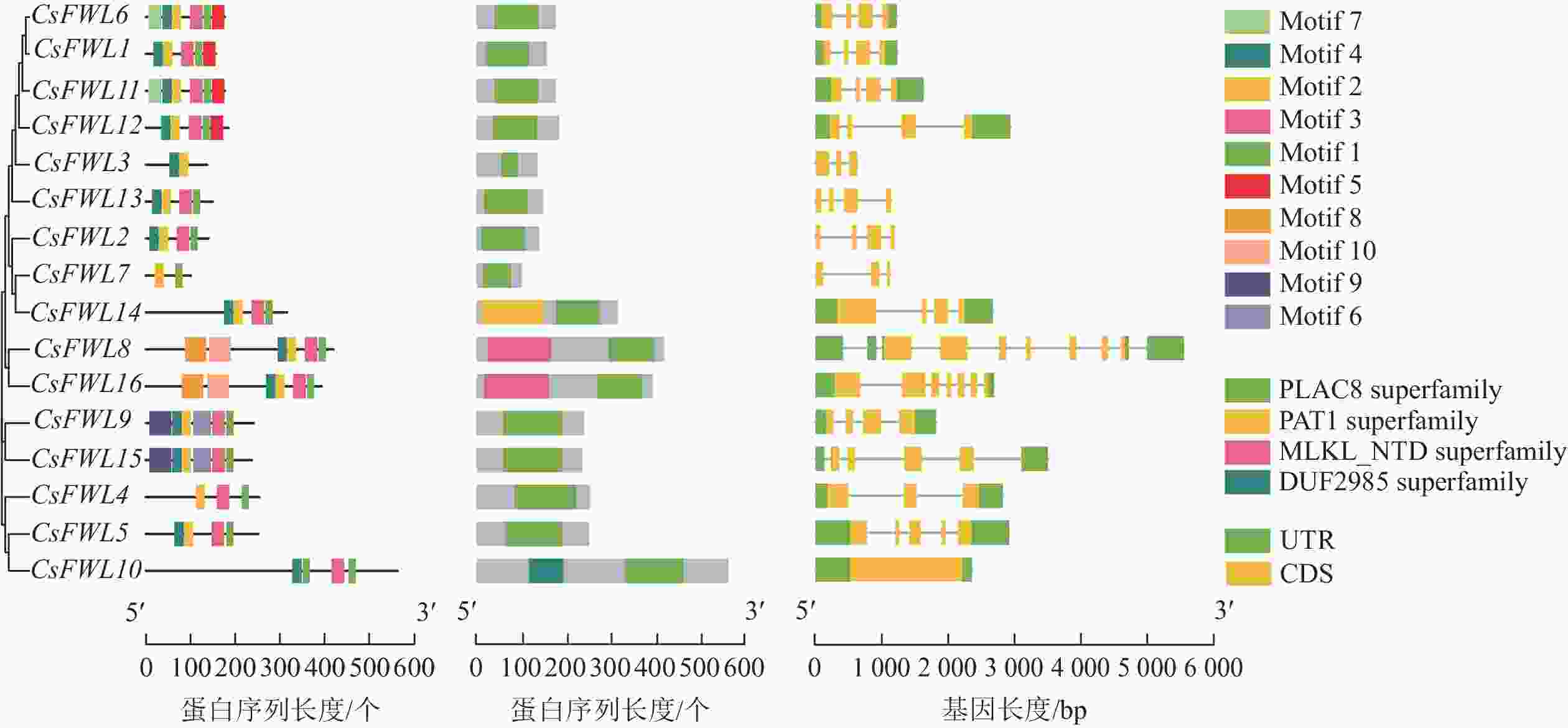
如图3所示:在甜橙CsFWLs蛋白中鉴定到10个氨基酸保守基序。其中,CsFWL3和CsFWL7具有2个基序,其他成员均含有4~6个基序。多数CsFW2.2基因都含有基序1/2/3。CsFWL8和CsFWL16具有相同的基序(基序1/2/3/4/8/10),CsFWL9和CsFWL15具有相同的基序(基序1/2/3/4/6/9)。保守结构域结果表明:所有CsFWLs蛋白均编码PLAC8结构域。除PLAC8结构域外,CsFWL8和CsFWL16还具有Mlkl_Nid结构域,CsFWL14具有Pat结构域,CsFWL10具有DUF2985结构域。外显子-内含子结构分析表明:CsFW2.2家族基因外显子数量呈现多样性,其中,CsFWL3、CsFWL4和CsFWL7有3个外显子,CsFWL8和CsFWL16有7个外显子,CsFWL5有5个外显子,CsFWL10有1个外显子,其他基因都是4个外显子。这表明CsFWLs基因可能会因基因结构差异而导致功能不同。
-
为进一步了解CsFW2.2家族基因的调控机制,对CsFW2.2家族基因起始密码子上游2 000 bp区域进行顺式调控元件分析。剔除CAAT-box、TATA-box等元件后,共注释到26种顺式调控元件,主要与胁迫、激素、植物生长发育等相关(图4)。所有CsFW2.2基因均含有光响应元件。CsFWLs基因的启动子中含有1个或多个与激素调控相关的顺式作用元件,如赤霉素(GA)、茉莉酸甲酯(MeJA)、脱落酸(ABA)、生长素(IAA)、水杨酸(SA)等响应元件。同时,CsFWLs启动子上还含有种子特异性调控、分生组织表达、昼夜节律控制和胚乳表达等生长发育调控元件以及低温、干旱、创伤、厌氧诱导、防御等胁迫响应元件。
-
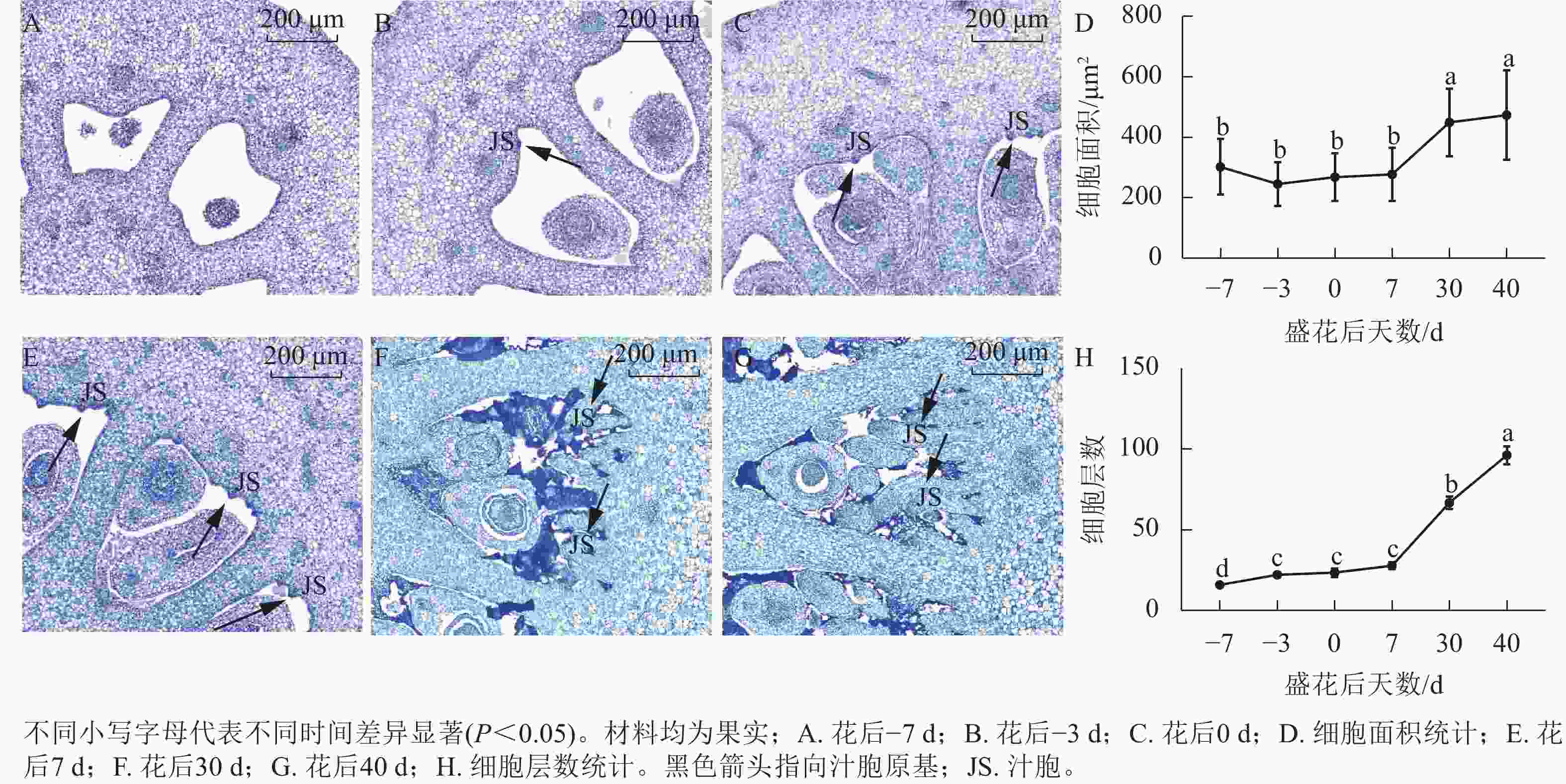
对花后−7、−3、0、7、30和40 d果实进行石蜡切片分析,结果显示(图5):花后−3 d,汁胞原基出现并逐渐伸长。花后0到7 d,果实内细胞层数和细胞大小没有显著变化。花后30 d,细胞层数和细胞大小都显著增加(P<0.05)。前人研究发现:番茄FW2.2负调控细胞分裂[11]。为探究甜橙FW2.2家族基因与果实细胞分裂的关系,对其在‘锦红’花后0、7、30和40 d果实进行基因表达及相关系数分析。由图6可知:CsFWL2、CsFWL3、CsFWL7和CsFWL13等4个基因在果实组织中未检测到,其余CsFWLs基因在果实中均有表达,并且它们在果实细胞分裂期的表达趋势存在差异,CsFWL1的表达趋势呈先下降后上升,CsFWL15和CsFWL16呈下降趋势,其他基因均呈先上升后下降的趋势(图6)。CsFWL5、CsFWL6、CsFWL9、CsFWL12和CsFWL16在花后30和40 d时表达量下降,且经相关系数分析,CsFWL5、CsFWL6和CsFWL12表达趋势与细胞层数之间呈极显著负相关(P<0.01,表3)。说明CsFWL5、CsFWL6和CsFWL12极可能参与调控细胞分裂过程。
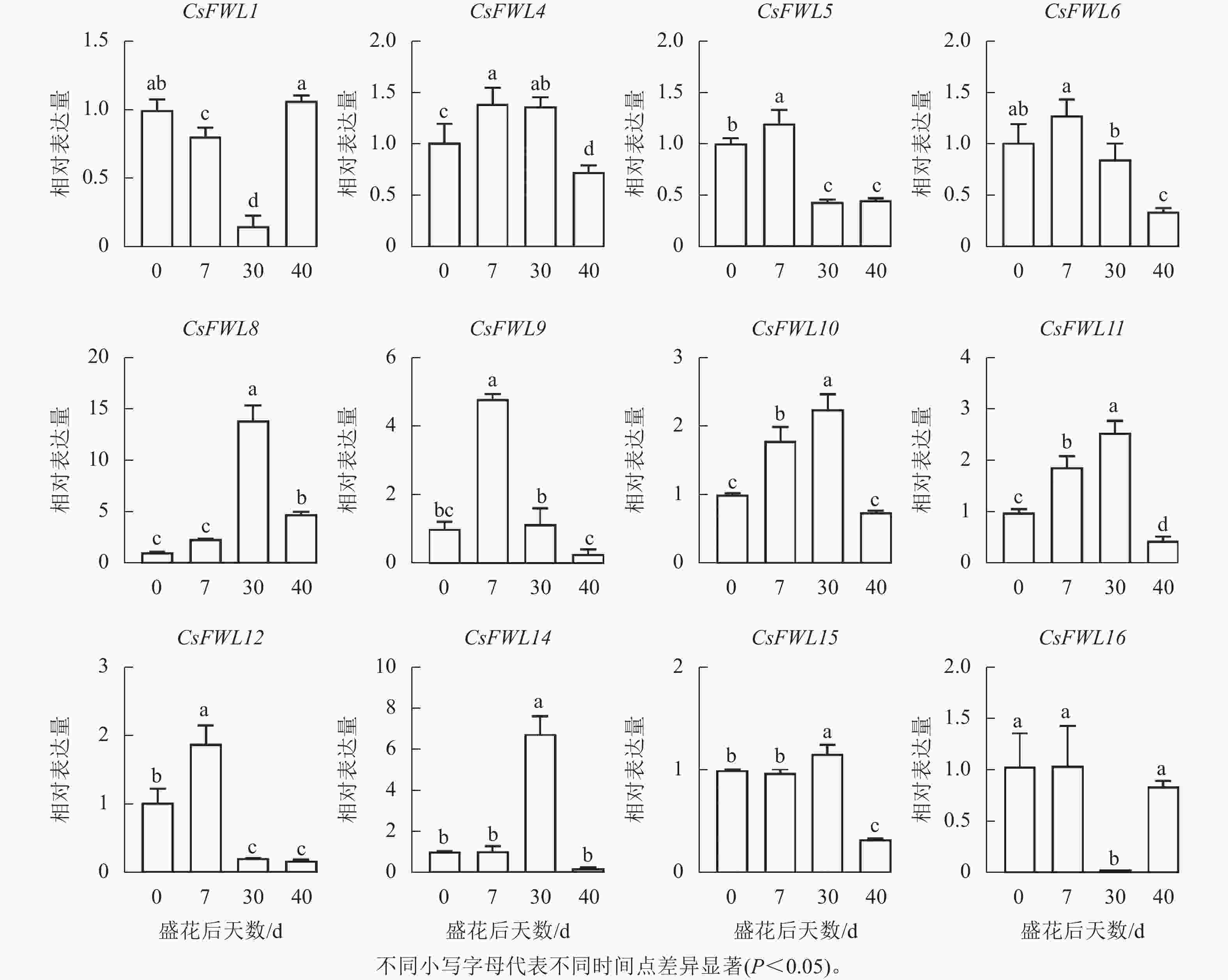
图 6 甜橙FW2.2家族基因在果实不同时期中的表达分析
Figure 6. Expression analysis of FW2.2 family genes in fruit under different stages
表 3 甜橙FW2.2家族基因相对表达量与细胞层数的相关性分析
Table 3. Correlation analysis between CsFW2.2 family genes expression and cell layer
基因 相关系数 基因 相关系数 基因 相关系数 CsFWL1 −0.108 CsFWL8 0.515 CsFWL12 −0.835** CsFWL4 −0.485 CsFWL9 −0.629* CsFWL14 0.166 CsFWL5 −0.902** CsFWL10 −0.183 CsFWL15 −0.642* CsFWL6 −0.868** CsFWL11 −0.242 CsFWL16 −0.427 说明:*. P<0.05;**. P<0.01。 -
番茄FW2.2作为细胞分裂过程中的负调控因子影响果实大小[11, 27−28]。FW2.2在单子叶和双子叶植物中的功能比较保守,都参与器官大小调控[7]。目前,FW2.2基因家族在桃[17]、番茄[23]、玉米[24]、水稻[25]和梨[26]等多个物种里得到系统鉴定。然而,柑橘作为世界第一大水果,其FW2.2基因家族尚未见系统的研究报道。本研究通过生物信息学方法从甜橙基因组中鉴定到16个CsFWLs基因。CsFWLs蛋白的理化性质与其他植物中的FWL蛋白具有一定的相似性[26, 29]。多数CsFWLs蛋白的不稳定性指数大于40.00,属于不稳定蛋白。此外,亲水系数小于0,属于亲水蛋白。
基因结构会影响基因功能,基因结构差异也能反映出基因家族的进化关系。CsFWLs基因的外显子数量差异较大,如CsFWL8和CsFWL16含有7个外显子,而CsFWL10有1个外显子,发育进化树上CsFWL10与CsFWL8、CsFWL16分布在不同的分支上,暗示着它们可能在进化过程中分化出不同的基因功能。
PLAC8结构域与跨膜功能相关,在细胞膜位置表达。本研究中CsFWLs蛋白都含有PLAC8结构域,这与番茄[23]、枣Ziziphus jujuba[30]等物种的研究结果一致。亚细胞预测结果表明:所有CsFWLs蛋白定位在细胞膜,同时也存在核膜共定位的情况。这种双定位情况的出现是正常的[31],同时,也可能是由预测不准确引起的。已有研究报道:FW2.2通过调节果实发育过程中胞间连丝的运输能力和信号分子运输,在细胞间信号传递中发挥负调控作用[32]。这暗示CsFWLs基因可能是通过膜间信号传递行使基因功能。
CsFWLs基因启动子上具有赤霉素、脱落酸、生长素等激素响应元件,暗示甜橙FW2.2基因可能参与多种激素响应的生物学过程。柑橘果实发育遵循单S型生长曲线,可分为细胞分裂期、细胞膨大期和成熟期。石蜡切片结果显示:花后7 d果实细胞分裂活动开始活跃。CsFWLs在果实细胞分裂阶段表现出不同的表达趋势,其中,CsFWL5、CsFWL6、CsFWL9、CsFWL12、CsFWL16表达量下降。基因相对表达量与细胞层数的相关分析表明:CsFWL5、CsFWL6和CsFWL12表达水平与细胞层数呈极显著负相关,表明这3个基因可能在细胞分裂过程起负调控作用。该发现与番茄[14, 33]和牛油果[16]中FW2.2功能一致,暗示CsFWL5、CsFWL6和CsFWL12可能是通过参与细胞分裂过程来影响果实大小,但其具体功能还需进一步验证。本研究结果为研究甜橙FW2.2家族基因在果实大小发育中的功能提供了理论基础。
-
本研究从甜橙全基因组数据中鉴定出16个FW2.2基因家族成员,并通过系统进化分析将其划分成6个分支。甜橙FW2.2家族成员之间在进化过程中具有一定的保守性,与梨、桃、番茄等作物FWLs基因存在序列相似性。甜橙FW2.2家族成员可能在胁迫、激素响应等方面发挥作用。相关系数的分析结果表明:CsFWL5、CsFWL6和CsFWL12基因可能在细胞分裂期起负调控作用。
本文已在中国知网网络首发,可在知网搜索、下载并阅读全文。
甜橙FW2.2家族基因鉴定及在果实细胞分裂期的表达分析
DOI: 10.11833/j.issn.2095-0756.20250431
Identification of FW2.2 family gene in Citrus sinensis and expression analysis during fruit cell division period
-
摘要:
目的 鉴定甜橙Citrus sinensis FW2.2基因家族成员,分析FW2.2家族成员的结构特征及其在果实细胞分裂期的表达模式,为探究FW2.2在甜橙果实发育中的基因功能提供理论依据。 方法 以甜橙全基因组数据为基础筛选确定甜橙FW2.2家族成员。运用生物信息学方法预测分析其基因结构、序列特征、染色体定位和顺式作用元件,并与多个物种的FW2.2家族序列构建发育进化树。利用实时荧光定量聚合酶链式反应(RT-qPCR)技术分析甜橙FW2.2家族基因在甜橙果实细胞分裂时期的表达趋势。 结果 FW2.2家族在甜橙基因组中有16个成员。它们分布在6条染色体上,长度为100~563个氨基酸,含有2个以上的保守基序,主要定位在细胞膜。进化分析表明:甜橙、番茄Solanum lycopersicum、梨Pyrus bretschneideri、桃Prunus persica、玉米Zea mays及水稻Oryza sativa中FW2.2成员分为6个亚组。顺式元件分析显示:FW2.2家族基因启动子上均含有与激素、生长发育、非生物胁迫相关的元件。基因表达分析表明:FW2.2家族成员在果实细胞分裂期的表达趋势存在差异。CsFWL5、CsFWL6、CsFWL12在果实细胞分裂期的表达量显著降低,且与细胞层数增长呈极显著负相关(P<0.01)。 结论 CsFWLs成员在进化过程中表现出一定的保守性,且跟梨、桃、番茄等作物FWLs基因序列存在相似性。甜橙FW2.2基因家族成员间功能不同,其中甜橙CsFWL5/6/12可能参与调控果实细胞分裂过程。图6表3参33 Abstract:Objective This study aims to identify the members of the FW2.2 family in Citrus sinensis and analyze their structural characteristics and expression patterns during the fruit cell division period, so as to provide a theoretical basis for exploring the function of the FW2.2 gene family in C. sinensis fruit development. Method Based on the whole genome data of C. sinensis, FW2.2 family members were screened and identified. Bioinformatics methods were employed to predict and analyze their gene structure, sequence characteristics, chromosome localization, and cis-acting elements. A phylogenetic tree was constructed with FW2.2 sequences from multiple species. The expression patterns of FW2.2 family members during the fruit cell division period were analyzed by real-time fluorescence quantitative polymerase chain reaction (RT-qPCR) technology. Result A total of 16 FW2.2 genes were identified in C. sinensis, distributed on 6 chromosomes, with a length of 100 to 563 amino acids, containing multiple conserved motifs, and mainly located in the cell membrane. Evolutionary analysis revealed that FW2.2 family members from C. sinensis, Solanum lycopersicum, Pyrus bretschneideri, Prunus persica, Zea mays and Oryza sativa were divided into 6 subgroups. Cis-acting elements analysis showed that the promoters of FW2.2 family genes contained elements related to the hormone, growth and development, and abiotic stress. Gene expression analysis showed that there were differences in the expression trends of FW2.2 family genes during the fruit cell division period. The expression levels of CsFWL5, CsFWL6 and CsFWL12 decreased significantly during the fruit cell division period, and were negatively correlated with the increase in cell layers (P<0.01). Conclusion CsFWLs members exhibit a certain degree of conservation during evolution, and share sequence similarities with FWLs genes in crops such as Pyrus bretschneideri, Prunus persica, and S. lycopersicum. CsFWLs show different gene functions. CsFWL5, CsFWL6 and CsFWL12 may be involved in regulating fruit cell division. [Ch, 6 fig. 3 tab. 33 ref.] -
Key words:
- Citrus sinensis /
- FW2.2 /
- genome-wide identification /
- cell division /
- expression analysis
-
表 1 RT-qPCR引物序列
Table 1. Primer sequence of RT-qPCR
基因 正向引物序列 反向引物序列 CsFWL1 ACTGCTTCTCCGACTGCTCAAC GCAGCCTGTCAGCCAAGCTATT CsFWL2 ACTGCCTCCTCTCATGCGTG TCTAGATGGGTCGAGTCCCC CsFWL3 CCAACACAACCACAAGCA GTCGTCACAGCAATCACA CsFWL4 AAATCACTGCCTGCCTTACTCT TCTTCCACGCAACTTCCACAAC CsFWL5 AAGAGAAGGCGGGTGGTGAAGAG AGGCGGATTGGAGAGCGATGGG CsFWL6 CTTGCTTATACTCGTGCGGCTATC TTTCTCCAAATTTCCATGCCATCC CsFWL7 ACTGCGTCCCTCACTTCT GGTTCCTGTTCCTCGTTC CsFWL8 TTCCTATCCAAAAATGGGGTT AATCACTTCACACTGGCTCACA CsFWL9 CCGCTACCGGAAAGCTACGAG AAGTGCCAATCCACCTTCAATAC CsFWL10 GCTGTTGTTGGTGTACTCTTGCT CGTGGCAAAGGTGACAACTGAT CsFWL11 GGTGACTGGCTGCGGGTGCTTAT ACATGTCGAATCCACGGGCTTTG CsFWL12 GCTTGGTTCATTGCTGTTGCT GAGTCTCTTTCTCTACATTCCC CsFWL13 TTGCGGCGACACTATTCATT CCAACCTATGGAGGGATTAACA CsFWL14 AGCAAGTTCAACCTCCCCGAAG AATAGAAGGATCCCAGCCTCTG CsFWL15 ATGTGGAAAAGATGAGAGAA ACCAAGCAAAAAACAAACCC CsFWL16 AAACTTTTAACATTCAGGGCGG GGCTTCATATATTGGTACGGCG 表 2 甜橙FW2.2家族基因的基本信息
Table 2. Detailed information of identified FW2.2 genes in C. sinensis
基因名称 基因ID 氨基酸数/个 分子量/kD 等电点 不稳定系数 亲水系数 亚细胞定位 CsFWL1 Cs_ont_2g013230 156 17.29 5.30 53.89 −0.066 细胞膜 CsFWL2 Cs_ont_9g009130 139 15.34 8.28 44.43 0.083 细胞膜 CsFWL3 Cs_ont_7g019620 136 14.60 5.11 60.76 0.132 细胞膜 CsFWL4 Cs_ont_6g019810 253 27.20 5.34 57.84 −0.328 细胞膜 CsFWL5 Cs_ont_2g006240 251 28.26 5.20 38.54 −0.112 细胞膜 CsFWL6 Cs_ont_2g013260 176 19.36 7.02 45.13 −0.151 细胞膜 CsFWL7 Cs_ont_5g036960 100 11.69 8.86 46.13 −0.503 细胞膜、细胞核 CsFWL8 Cs_ont_1g028600 419 48.20 7.09 51.40 −0.503 细胞膜、细胞核 CsFWL9 Cs_ont_5g001070 240 26.38 4.78 49.87 −0.163 细胞膜 CsFWL10 Cs_ont_7g002410 563 63.60 9.06 49.82 −0.190 细胞膜 CsFWL11 Cs_ont_2g013300 176 19.27 6.62 40.79 −0.069 细胞膜 CsFWL12 Cs_ont_2g013320 184 20.75 8.27 44.87 −0.179 细胞膜、细胞核 CsFWL13 Cs_ont_7g019640 149 16.65 6.39 58.53 −0.195 细胞膜 CsFWL14 Cs_ont_5g036990 315 34.55 5.42 57.59 −0.564 细胞膜、细胞核 CsFWL15 Cs_ont_9g023590 236 26.27 4.90 46.47 −0.353 细胞膜 CsFWL16 Cs_ont_7g001970 393 44.39 5.80 40.20 −0.268 细胞膜、细胞核 表 3 甜橙FW2.2家族基因相对表达量与细胞层数的相关性分析
Table 3. Correlation analysis between CsFW2.2 family genes expression and cell layer
基因 相关系数 基因 相关系数 基因 相关系数 CsFWL1 −0.108 CsFWL8 0.515 CsFWL12 −0.835** CsFWL4 −0.485 CsFWL9 −0.629* CsFWL14 0.166 CsFWL5 −0.902** CsFWL10 −0.183 CsFWL15 −0.642* CsFWL6 −0.868** CsFWL11 −0.242 CsFWL16 −0.427 说明:*. P<0.05;**. P<0.01。 -
[1] 吴锦秋, 白海坤, 王楚, 等. 不同砧穗组合对杏果实大小及品质的影响[J]. 西北农林科技大学学报(自然科学版), 2025, 53(9): 93−103. WU Jinqiu, BAI Haikun, WANG Chu, et al. Effects of different rootstock-scion combinations on fruit size and quality of apricot[J]. Journal of Northwest A&F University (Natural Science Edition), 2025, 53(9): 93−103. DOI:10.13207/j.cnki.jnwafu.2025.09.010. [2] GUARDIOLA J L, GARCÍA-LUIS A. Increasing fruit size in Citrus. Thinning and stimulation of fruit growth[J]. Plant Growth Regulation, 2000, 31(1): 121−132. DOI: 10.1023/A:1006339721880. [3] YILMAZ B, CIMEN B, INCESU M, et al. Influence of girdling on the seasonal leaf nutrition status and fruit size of Robinson mandarin (Citrus reticulata Blanco)[J]. Applied Ecology and Environmental Research, 2018, 16(5): 6205−6218. DOI: 10.15666/aeer/1605_62056218. [4] LIU Cong, LI Dexiong, HUANG Xianbiao, et al. Manual thinning increases fruit size and sugar content of Citrus reticulata Blanco and affects hormone synthesis and sugar transporter activity[J]. Journal of Integrative Agriculture, 2022, 21(3): 725−735. DOI: 10.1016/S2095-3119(20)63502-X. [5] FERRER C, MARTIZ J, SAA S, et al. Increase in final fruit size of tangor (Citrus reticulata × C. sinensis) cv W. Murcott by application of benzyladenine to flowers[J]. Scientia Horticulturae, 2017, 223: 38−43. DOI: 10.1016/j.scienta.2017.05.030. [6] de JONG M, WOLTERS-ARTS M, SCHIMMEL B C J, et al. Solanum lycopersicum auxin response factor 9 regulates cell division activity during early tomato fruit development[J]. Journal of Experimental Botany, 2015, 66(11): 3405−3416. DOI: 10.1093/jxb/erv152. [7] BEAUCHET A, GÉVAUDANT F, GONZALEZ N, et al. In search of the still unknown function of FW2.2/CELL NUMBER REGULATOR, a major regulator of fruit size in tomato[J]. Journal of Experimental Botany, 2021, 72(15): 5300−5311. DOI: 10.1093/jxb/erab207. [8] ZHAO Xuan, MUHAMMAD N, ZHAO Zixuan, et al. Molecular regulation of fruit size in horticultural plants: a review[J]. Scientia Horticulturae, 2021, 288: 110353. DOI: 10.1016/j.scienta.2021.110353. [9] DONG Yuanxin, QI Xiliang, LIU Congli, et al. A sweet cherry AGAMOUS-LIKE transcription factor PavAGL15 affects fruit size by directly repressing the PavCYP78A9 expression[J]. Scientia Horticulturae, 2022, 297: 110947. DOI: 10.1016/j.scienta.2022.110947. [10] KARIM S K A, ALLAN A C, SCHAFFER R J, et al. Cell division controls final fruit size in three apple (Malus × domestica) cultivars[J]. Horticulturae, 2022, 8(7): 657. DOI: 10.3390/horticulturae8070657. [11] FRARY A, NESBITT T C, GRANDILLO S, et al. fw2.2: a quantitative trait locus key to the evolution of tomato fruit size[J]. Science, 2000, 289(5476): 85−88. DOI: 10.1126/science.289.5476.85. [12] van DER KNAAP E, TANKSLEY S D. The making of a bell pepper-shaped tomato fruit: identification of loci controlling fruit morphology in Yellow Stuffer tomato[J]. Theoretical and Applied Genetics, 2003, 107(1): 139−147. DOI: 10.1007/s00122-003-1224-1. [13] LIBAULT M, STACEY G. Evolution of FW2.2-like (FWL) and PLAC8 genes in eukaryotes[J]. Plant Signaling & Behavior, 2010, 5(10): 1226−1228. DOI: 10.4161/psb.5.10.12808. [14] TIAN Jia, ZENG Bin, LUO Shuping, et al. Cloning, localization and expression analysis of two fw2.2-like genes in small- and large-fruited pear species[J]. Journal of Integrative Agriculture, 2016, 15(2): 282−294. DOI: 10.1016/S2095-3119(15)61075-9. [15] 蒲小秋. 梨fw2.2-like基因家族的鉴定、表达及相关基因的功能验证[D]. 乌鲁木齐: 新疆农业大学, 2023. PU Xiaoqiu. Identification and Expression of Pear fw2.2-Like Gene Family and Functional Verification of Related Genes[D]. Urumqi: Xinjiang Agricultural University, 2023. [16] DAHAN Y, ROSENFELD R, ZADIRANOV V, et al. A proposed conserved role for an avocado fw2.2-like gene as a negative regulator of fruit cell division[J]. Planta, 2010, 232(3): 663−676. DOI: 10.1007/s00425-010-1200-3. [17] de FRANCESCHI P, STEGMEIR T, CABRERA A, et al. Cell number regulator genes in Prunus provide candidate genes for the control of fruit size in sweet and sour cherry[J]. Molecular Breeding, 2013, 32(2): 311−326. DOI: 10.1007/s11032-013-9872-6. [18] SU Wenbing, ZHANG Ling, JIANG Yuanyuan, et al. EjFWLs are repressors of cell division during early fruit morphogenesis of loquat[J]. Scientia Horticulturae, 2021, 287: 110261. DOI: 10.1016/j.scienta.2021.110261. [19] YU Yuan, CHEN Chunxian, GMITTER F G. QTL mapping of mandarin (Citrus reticulata) fruit characters using high-throughput SNP markers[J]. Tree Genetics & Genomes, 2016, 12(4): 77. DOI: 10.1007/s11295-016-1034-7. [20] IMAI A, YOSHIOKA T, HAYASHI T. Quantitative trait locus (QTL) analysis of fruit-quality traits for mandarin breeding in Japan[J]. Tree Genetics & Genomes, 2017, 13(4): 79. DOI: 10.1007/s11295-017-1162-8. [21] 罗艾, 龚桂芝, 彭祝春, 等. 柑橘果实大小与质量的遗传分析和数量性状位点定位[J]. 浙江大学学报(农业与生命科学版), 2021, 47(6): 719−728. LUO Ai, GONG Guizhi, PENG Zhuchun, et al. Genetic analysis and quantitative trait loci mapping of Citrus fruit size and quality[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2021, 47(6): 719−728. DOI: 10.3785/j.issn.1008-9209.2021.04.121. [22] HAMADA K, HASEGAWA K, KITAJIMA A, et al. The relationship between fruit size and cell division and enlargement in cultivated and wild persimmons[J]. The Journal of Horticultural Science and Biotechnology, 2008, 83(2): 218−222. DOI: 10.1080/14620316.2008.11512372. [23] NESBITT T C, TANKSLEY S D. Comparative sequencing in the genus Lycopersicon. Implications for the evolution of fruit size in the domestication of cultivated tomatoes[J]. Genetics, 2002, 162(1): 365−379. DOI: 10.1093/genetics/162.1.365. [24] GUO Mei, RUPE M A, DIETER J A, et al. Cell Number Regulator1 affects plant and organ size in maize: implications for crop yield enhancement and heterosis[J]. The Plant Cell, 2010, 22(4): 1057−1073. DOI: 10.1105/tpc.109.073676. [25] XU Jun, XIONG Wentao, CAO Baobao, et al. Molecular characterization and functional analysis of “fruit-weight2.2-like” gene family in rice[J]. Planta, 2013, 238(4): 643−655. DOI: 10.1007/s00425-013-1916-y. [26] PU Xiaoqiu, TIAN Jia, LI Jiang, et al. Genome-wide identification and expression analysis of the fw2.2-like gene family in pear[J]. Horticulturae, 2023, 9(4): 429. DOI: 10.3390/horticulturae9040429. [27] NESBITT T C, TANKSLEY S D. fw2.2 directly affects the size of developing tomato fruit, with secondary effects on fruit number and photosynthate distribution[J]. Plant Physiology, 2001, 127(2): 575−583. DOI: 10.1104/pp.010087. [28] LIU Jiping, CONG Bin, TANKSLEY S D. Generation and analysis of an artificial gene dosage series in tomato to study the mechanisms by which the cloned quantitative trait locus fw2.2 controls fruit size[J]. Plant Physiology, 2003, 132(1): 292−299. DOI: 10.1104/pp.102.018143. [29] ZHANG M W, ZHANG T K, YUAN Z H. Pomegranate PLAC8 family[J]. Acta Horticulturae, 2019, 1254: 35−40. DOI: 10.17660/actahortic.2019.1254.6. [30] LI Meiyu, MAO Liyun, SONG Shuang, et al. Functional insights into the FW2.2-like gene family in Chinese jujube: identification, characterization, and impact of ZjFWL10 variants on fruit size and plant height[J]. Journal of Integrative Agriculture, 2025, 24(10): 3880−3894. DOI: 10.1016/j.jia.2025.02.017. [31] ARNOYS E J, WANG J L. Dual localization: proteins in extracellular and intracellular compartments[J]. Acta Histochemica, 2007, 109(2): 89−110. DOI: 10.1016/j.acthis.2006.10.002. [32] BEAUCHET A, BOLLIER N, GRISON M, et al. The cell number regulator FW2.2 protein regulates cell-to-cell communication in tomato by modulating callose deposition at plasmodesmata[J]. Plant Physiology, 2024, 196(2): 883−901. DOI: 10.1093/plphys/kiae198. [33] CONG Bin, LIU Jiping, TANKSLEY S D. Natural alleles at a tomato fruit size quantitative trait locus differ by heterochronic regulatory mutations[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(21): 13606−13611. DOI: 10.1073/pnas.172520999. -

-
链接本文:
https://zlxb.zafu.edu.cn/article/doi/10.11833/j.issn.2095-0756.20250431






 下载:
下载: